沪教版2018年中考化学模拟试卷(二)
试卷更新日期:2018-04-24 类型:中考模拟
一、单选题
-
1. 绿色能源是理想的能源,不会造成环境污染,下列不属于绿色能源的是 ( )
A、风能 B、太阳能 C、煤 D、氢能源2. 下列发生在厨房中的变化属于物理变化的是( )A、鲜奶制酸奶 B、米醋除水垢 C、葡萄酿成酒 D、脐橙榨果汁3. 下列实验现象的描述正确的是( )A、蜡烛在空气中燃烧生成二氧化碳和水 B、红磷在空气中燃烧产生大量白烟 C、硫在氧气中燃烧产生淡蓝色火焰 D、镁条在空气中剧烈燃烧,发出耀眼白光,生成白色的氧化镁固体4. 将空的矿泉水瓶从高原地区带到平原,瓶子变瘪,原因是瓶内气体( ) A、分子体积变小 B、分子质量变小 C、分子间隔变小 D、分子数目减少5. 下列实验操作正确的是( )A、
A、分子体积变小 B、分子质量变小 C、分子间隔变小 D、分子数目减少5. 下列实验操作正确的是( )A、 过滤操作
B、
过滤操作
B、 取用药品
C、
取用药品
C、 读出液体体积
D、
读出液体体积
D、 称量药品
6. 分类法是化学学习和研究的重要方法之一.下列分类正确的是( )A、单质:金刚石、水、液氧 B、碱:烧碱、纯碱、氨水 C、混合物:煤、石油、空气 D、有机物:乙酸、乙醇、碳酸钙7. 小明同学对所学部分化学知识归纳如下,其中完全正确 的一组是( )
称量药品
6. 分类法是化学学习和研究的重要方法之一.下列分类正确的是( )A、单质:金刚石、水、液氧 B、碱:烧碱、纯碱、氨水 C、混合物:煤、石油、空气 D、有机物:乙酸、乙醇、碳酸钙7. 小明同学对所学部分化学知识归纳如下,其中完全正确 的一组是( )A.物质的分类
B.资源的利用和保护
①合成橡胶、合金都属于合成材料
②氧化物中含有氧元素
③混合物中一定含有多种元素
①保护空气要减少有害气体和烟尘的排放
②爱护水资源要节约用水和防止水体污染
③保护金属资源只能通过防止金属腐蚀实现
C.“低碳经济”的措施
D.用“化学”眼光分析
①改造或淘汰高能耗、高污 染产业
②研制和开发新能源替代传统能源
③减少使用一次性塑料方便袋
①铝不易生锈是因为铝不易与氧气反应
②湿衣服晾干是因为分子之间有间隔
③不能用铁桶盛装稀硫酸是因为二者发生化学反应
A、A B、B C、C D、D8. 为除去下列物质中的杂质(括号内是杂质),下列方法正确的是( )选项
物质
方法
A
Cu(NO3)2溶液(AgNO3)
加入足量铁粉,充分反应后过滤
B
CuSO4溶液 (H2SO4)
加入过量CuO粉末,微热,充分反应后过滤
C
NaOH溶液(Ca(OH)2)
加入过量碳酸钠溶液,充分反应后过滤
D
CaO粉末(CaCO3)
加足量的水,充分搅拌后过滤
A、A B、B C、C D、D9. 分析推理是化学学习方法之一.下列推理中,正确的是( )A、同种元素的原子具有相同质子数,则具有相同质子数的两种粒子一定是同种元素 B、由同种分子构成的物质是纯净物,所以纯净物一定由同种分子构成 C、氧化物中含有氧元素,所以含有氧元素的物质就是氧化物 D、当元素原子的最外层电子数达到8个电子时,元素的性质比较稳定,氖原子核最外层电子数为8,所以氖气的化学性质比较稳定10. 下列叙述与对应的坐标图表示正确的是( )A、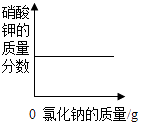 向硝酸钾的饱和溶液中加入氯化钠
B、
向硝酸钾的饱和溶液中加入氯化钠
B、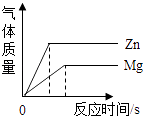 将相同质量的Zn粉和Mg粉分别加入足量的稀盐酸中
C、
将相同质量的Zn粉和Mg粉分别加入足量的稀盐酸中
C、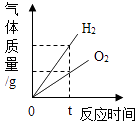 水的电解
D、
水的电解
D、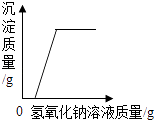 向盐酸和氯化铁混合溶液中加入过量的氢氧化钠溶液
向盐酸和氯化铁混合溶液中加入过量的氢氧化钠溶液
二、填空题
-
11. 从分子、原子的角度认识化学反应是化学研究的基本方法,如图是某密闭容器中物质变化过程的微观示意图.(“
 ”表示氧原子,“
”表示氧原子,“  ”表示氢原子)
”表示氢原子)
请回答:
(1)、变化Ⅰ的化学化学方程式是(2)、下列关于变化Ⅱ的说法中,正确的是 (填写序号).A.分子的数目增多了 B.分子变小了
C.分子间的距离变小了 D.分子的种类发生了改变
(3)、从变化Ⅱ的微观过程可分析出,该变化过程的一条宏观信息是12.NaCl 和KNO3在不同温度时的溶解度如下,回答下列问题。
温度/℃ 0 10 20 30 40 50 60 溶解度/g NaCl 35.7 35.8 36.0 36.3 36.6 37.0 37.3 KNO3 13.3 20.9 31.6 45.8 63.9 85.5 110 (1)10℃时,在100 g水里溶解 g KNO3时,溶液恰好达到饱和状态。
(2)右图为NaCl 和KNO3的溶解度曲线,则表示NaCl的溶解度曲线是 (填“甲”或“乙”);其中温度t的范围可能在 (填字母序号)。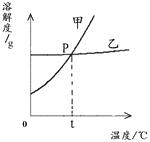
A.10℃~20℃ B.20℃~30℃ C.30℃~40℃ D.40℃~50℃
(3)10℃时,分别在100 g水中加入35 g NaCl 和KNO3固体,加热到60℃时,NaCl溶液为 (填“饱和”或“不饱和”)溶液。加热前后,有关两溶液的说法正确的是 (填字母序号)。
A.10℃时,两溶液中溶质的质量分数相同
B.60℃时,两溶液中溶质的质量分数相同
C.加热前后,NaCl溶液中溶质的质量分数不变
D.加热前后,KNO3溶液中溶质的质量分数不变13.“铁、锌、铜、镁、铝”是生活中常见的金属.请根据所学知识回答下列问题:(1)铝块能制成铝箔是利用了铝的性.
(2)黄铜是铜锌合金,其硬度比纯铜(填“大”或“小”).
(3)将一定质量的锌粒投入含有Cu(NO3)2和Fe(NO3)2的混合溶液中,充分反应后过滤,若滤液中只含一种溶质,则滤渣中一定含有.
(4)将等质量的镁、铁、锌三种金属分別放入三份溶质质量分数相等的稀盐酸中.生成H2的质量与反应时间的关系如图所示.金属X是(填化学式,下同),反应后可能已经反应完的金属是 , 一定有剩余的金属是 .
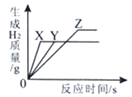 14.
14.如图是实验中常用仪器装置,请回答下列问题:

(1)指出带有标号的仪器名称:①②
(2)实验室用氯酸钾和二氧化碳混合加热制取氧气,应选用的发生装置是(填字母,下同),收集装置是 , 氯酸钾和二氧化碳混合加热制取氧气的化学方程式是检查收集到的气体是氧气的方法是 .
(3)若实验室制取二氧化碳气体,应选用的发生装置是(填字母,下同)检验二氧化碳气体收集满的方法是
(4)如图的F装置有多种用途,若用F装置收集氢气,气体应从(填“a”或“b”)端导管导入.若用F装置除去一氧化碳气体中混有的二氧化碳气体,瓶中应盛放的试剂是溶液(用化学式填写).反应的化学方程式为 .
(5)若二氧化碳气体通入紫色石蕊试液中,可以看到紫色石蕊试液变色.原因是(用化学方程式表示).15.氯化钠在自然界中分布很广,海水里含大量氯化钠.某氯化钠粗品中含少量氯化镁和氯化钙,某化学兴趣小组设计提纯方案如下:

(1)方案中加入过量试剂a若为氢氧化钠溶液,则其目的是为了除去氯化钠粗品中的某种杂质,写出该反应的化学方程式;
(2)在过滤操作中,除用到带铁圈的铁架台、烧杯、玻璃棒外,还需要用到玻璃仪器是;
(3)方案中加入过量试剂b应为溶液;
(4)向滤液B滴加稀盐酸的过程中,当观察到溶液的现象为时,应停止滴加,写出相关的化学方程式。
(5)操作C的名称为。三、实验探究题
-
16. 实验与探究是化学学习的重要方法和内容,李明看到家里多年未用的铜制火锅上有绿色的锈迹,他对绿色锈迹的成分和性质产生了浓厚兴趣.
【查阅资料】
①绿色锈迹是碱式碳酸铜[Cu2(OH)2CO3],受热易分解;
②无水硫酸铜为白色粉末,遇水变蓝;
③碱石灰是CaO和NaOH的固体混合物,NaOH与CO2反应生成碳酸钠固体和水
④氧化铜与稀硫酸反应生成蓝色溶液,碳粉不与稀硫酸反应也不溶解在稀硫酸中.
【发现问题】
查阅资料后,该同学将少量碱式碳酸铜放入试管中加热,发现试管中的固体由绿色变成黑色,同时试管壁上有无色液滴生成.
为了进一步确定碱式碳酸铜受热分解的产物,进行了如下探究:
探究一:碱式碳酸铜受热分解生成的黑色固体成分.
(1)、【猜想与假设】该黑色固体可能是①碳粉;②;③碳和氧化铜的混合物.(2)、【设计方案】请帮助该同学完成下述实验报告:实验操作与现象
实验结论
猜想②正确
探究二:碱式碳酸铜受热分解还会生成CO2和H2O.
【进行实验】选择如下图所示装置进行验证
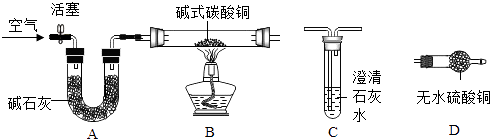
步骤一:连接A和B,打开活塞,通入一段时间的空气;
步骤二:点燃酒精灯,依次连接装置A→B→→(填“C”,“D”);
步骤三:点燃酒精灯,观察到明显现象后,停止加热
(3)、【解释与结论】①当观察到 , 说明碱式碳酸铜受热分解生成了CO2和H2O,写出装置C中反应的化学方程式;
②写出Cu2(OH)2CO3受热分解的化学方程式 .
(4)、【反思与评价】上述装置中A的作用是 .
四、解答题
-
17. 欲测定某氢氧化钠溶液中溶质的质量分数,取20g该氢氧化钠溶液,向其中滴加溶质质量分数为7.3%的稀盐酸至恰好完全反应,得到40g不饱和溶液,计算该氢氧化钠溶液中溶质的质量分数.
-