广西桂梧高中2017-2018学年高一下学期化学第一次月考考试试卷
试卷更新日期:2018-04-18 类型:月考试卷
一、单选题
-
1. 下列元素中,最高正化合价数值最大的是( )A、C B、F C、S D、Ne2. 已知某粒子 ,则元素R的原子序数是( )。A、Z B、A-Z C、Z-n D、Z+n3. 东晋炼丹家葛洪的《抱朴子》里记载“丹砂(HgS)烧之成水银,积变又还成了丹砂”这句话里没有涉及到的反应类型为( )A、氧化还原反应 B、化合反应 C、分解反应 D、置换反应4. 下列变化中,需加入氧化剂才能实现的是( )A、N2→NH3 B、MgCl2→MgSO4 C、Cu→CuO D、FeO→Fe5. 有A、B、C、D四种金属,投入水中只有D反应放出氢气,将A投入C的盐溶液中可置换出金属C,B的最高价氧化物的水化物碱性比A的最高价氧化物的水化物碱性强,则四种金属的金属性强弱顺序正确的是( )。A、A>B>C>D B、D>B>A>C C、B>A>C>D D、C>A>B>D6. 下列事实不能说明非金属性Cl>I的是( )A、Cl2+2I-=2Cl-+I2 B、稳定性:HCl>HI C、酸性:HClO4>HIO4 D、酸性:HClO3>HIO37. 下列说法错误的是( )A、原子半径:F<Mg<K B、稳定性:PH3>H2S>NH3 C、酸性:H3PO4<H2SO4<HClO4 D、碱性:Al(OH)3<Mg(OH)2<KOH8. 已知短周期元素的离子aW3+、bX+、cY2-、dZ-都具有相同的电子层结构,下列关系正确的是( )A、质子数c>b B、离子还原性Y2->Z- C、氢化物稳定性H2Y>HZ D、原子半径X<W9. 下列叙述正确的是( )A、O2分子间存在着非极性共价键 B、CO2分子内存在着极性共价键 C、SO2与H2O反应的产物是离子化合物 D、盐酸中含有H+和Cl- , 故HCl为离子化合物10. 下列只含有共价键的化合物是( )
A、HI B、NaOH C、Br2 D、NaCl11. 下列说法正确的是( )A、液态HCl、固体NaCl均不导电,所以HCl、NaCl均不是电解质 B、NH3、CO2的水溶液均能导电,所以NH3、CO2均是电解质 C、一束光线分别通过溶液和胶体时,前者会出现光亮的通路,后者则没有 D、分散系中分散质粒子的直径:Fe(OH)3 悬浊液>Fe(OH)3 胶体>FeCl3 溶液12. 亚硝酸钠(NaNO2)可将人体血红蛋白中的Fe2+氧化成Fe3+生成高铁血红蛋白而丧失与O2结合的能力。误食NaNO2中毒可用维生素C缓解。下列叙述中表现NaNO2和维生素C的性质的是( )A、还原性和氧化性 B、氧化性和还原性 C、氧化性和酸性 D、还原性和碱性13. 在下列条件下,一定能大量共存的离子组是( )A、无色透明的水溶液中,K+ , Mg2+ , I- , MnO4- B、滴入酚酞显红色的水溶液中,NH4+ , Fe2+ , SO42- , Cl- C、c(HCO3-)=0.1mol/L的溶液中,Na+ , K+ , CO32- , Br- D、使红色石蕊试纸变蓝的溶液中,H+ , Al3+ , Cl- , NO3-14. 已知I-、Fe2+、SO2和H2O2均有还原性,在酸性溶液中还原能力的强弱顺序为H2O2<Fe2+<I-<SO2 , 则下列反应不能发生的是( )A、2Fe3++SO2+2H2O=2Fe2++SO42-+4H+ B、H2O2+H2SO4=SO2↑+O2↑+2H2O C、I2+SO2+2H2O=H2SO4+2HI D、2Fe3++2I-=2Fe2++I215. 下面关于Na2CO3和NaHCO3性质的叙述,正确的是( )A、受热时NaHCO3比Na2CO3稳定 B、往Na2CO3和NaHCO3溶液中滴加酚酞都变红,说明Na2CO3和NaHCO3都是碱 C、NaHCO3能转化成Na2CO3 , 但Na2CO3不能转化成NaHCO3 D、物质的量相等的Na2CO3和NaHCO3分别与足量盐酸反应,放出的CO2的物质的量相等16. 在配制一定物质的量浓度的盐酸时,下列错误操作可使所配制溶液的浓度偏高的是( )
A、量取浓盐酸时仰视刻度线 B、定容时仰视容量瓶刻度线 C、用来配制溶液的容量瓶用蒸馏水洗涤后未进行干燥处理 D、定容摇匀时发现液面降低,又补加少量水重新达到刻度线二、综合题
-
17.(1)、同温同压下,有两瓶体积相等的CO和CO2 , 这两种气体中所含的分子数目之比为 ,质量比为。(2)、在Cu + 2H2SO4(浓) CuSO4+ SO2↑+ 2H2O反应中,
①是氧化剂。
②用双线桥标出该反应电子转移的方向和数目。
Cu + 2H2SO4(浓) CuSO4+ SO2↑+ 2H2O
③若有2.4mol的H2SO4参与反应,生成标况下的二氧化硫气体 L,转移电子的数目为。(NA表示阿伏加德罗常数的值)
三、实验题
-
18. 如图实验装置用于验证某些物质的性质.在试管A中装入足量的固体NaHCO3.试回答下列问题:
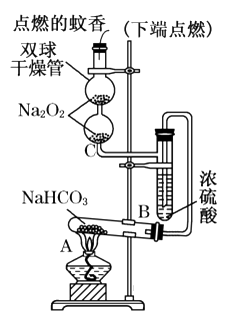 (1)、在A试管内发生反应的化学方程式是 .(2)、B装置的作用是 .(3)、在双球干燥管内发生反应的化学方程式为 .(4)、双球干燥管内观察到的实验现象是 . 上述实验现象说明 .(5)、若将干燥管内的Na2O2换成Na2O,则双球干燥管内观察到的实验现象是 .
(1)、在A试管内发生反应的化学方程式是 .(2)、B装置的作用是 .(3)、在双球干燥管内发生反应的化学方程式为 .(4)、双球干燥管内观察到的实验现象是 . 上述实验现象说明 .(5)、若将干燥管内的Na2O2换成Na2O,则双球干燥管内观察到的实验现象是 .四、推断题
-
19. 同一周期的A、B、C、D、E为原子序数依次增大的短周期元素,已知A、B、E 3种原子最外层共有11个电子,且这3种元素的最高价氧化物的水化物两两皆能发生反应生成盐和水,C元素的最外层电子数比次外层电子数少4,D元素原子次外层电子数比最外层电子数多3。(1)、写出下列元素符号:A ,B , C , D , E(2)、A与E两元素可形成化合物,用电子式表示其化合物的形成过程:(3)、写出A、B两元素最高价氧化物对应的水化物相互反应的化学方程式:20. 下表是元素周期表的一部分,针对表中的①~⑩中元素,用元素符号或化学式填空回答以下问题:
主族
周期
IA
IIA
IIIA
IVA
VA
VIA
VIIA
0
二
①
②
三
③
④
⑤
⑥
⑦
⑧
四
⑨
⑩
(1)、在这些元素中,金属性最强的元素是 , 最活泼的非金属元素是(2)、化学性质最不活泼的元素是 , 其原子的原子结构示意图为;(3)、元素的最高价氧化物对应的水化物中酸性最强的是 , 碱性最强的是 ,(4)、在③~⑦元素中,原子半径最大的是 , 原子半径最小的是;
-
-