人教版高中化学选修五 第一章第四节:研究有机化合物的一般步骤和方法
试卷更新日期:2018-04-13 类型:同步测试
一、单选题
-
1. 下列实验操作不正确的是( )A、分液漏斗使用前需要先检查是否漏液 B、实验中剩余的钠不能再放回原试剂瓶 C、做焰色反应时,铂丝应用盐酸洗净并灼烧至无色 D、蒸馏烧瓶加热时需要垫石棉网2. 下列实验操作中错误的是( )A、蒸发操作时,当有大量晶体析出时停止加热,用余热使水蒸发。 B、蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处 C、分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 D、萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大3. 乙酸甲酯(CH3COOCH3)核磁共振氢谱的峰数为( )A、1 B、2 C、3 D、44. 两种烃A、B取等质量完全燃烧,生成CO2与消耗O2的量相同,这两种烃之间的关系正确的是( )
A、一定互为同分异构体 B、一定是同系物,有相同的通式 C、实验式相同 D、只能是同种物质5. 已知某有机物A的红外光谱和核磁共振氢谱图如下图所示,下列说法中不正确的是( ) A、由红外光谱可知,该有机物中至少有三种不同的化学键 B、由核磁共振氢谱图可知,该有机物分子中有三种不同的氢原子 C、仅由其核磁共振氢谱图无法得知其分子中的氢原子总数 D、若A的化学式为C2H6O,则其结构简式为CH3—O—CH36. 已知二甲醚和乙醇是同分异构体,下列鉴别方法中不可行的是( )A、利用金属钠 B、利用质谱法 C、利用红外光谱法 D、利用核磁共振氢谱7. 某有机物在氧气中充分燃烧,生成水蒸气和CO2的物质的量之比为1∶1,由此可以得出的结论是( )A、该有机物分子中C,H,O原子个数比为1∶2∶3 B、分子中C,H原子个数比为1∶2 C、有机物中必定含有氧 D、有机物中一定不含氧8. 某有机化合物只含C、H、O 三种元素且只含有一种官能团,其相对分子质量为58,该有机物完全燃烧时产生等物质的量的CO2和H2O.则它可能的结构共有(不考虑立体异构)( )A、3 种 B、4 种 C、5 种 D、6 种
A、由红外光谱可知,该有机物中至少有三种不同的化学键 B、由核磁共振氢谱图可知,该有机物分子中有三种不同的氢原子 C、仅由其核磁共振氢谱图无法得知其分子中的氢原子总数 D、若A的化学式为C2H6O,则其结构简式为CH3—O—CH36. 已知二甲醚和乙醇是同分异构体,下列鉴别方法中不可行的是( )A、利用金属钠 B、利用质谱法 C、利用红外光谱法 D、利用核磁共振氢谱7. 某有机物在氧气中充分燃烧,生成水蒸气和CO2的物质的量之比为1∶1,由此可以得出的结论是( )A、该有机物分子中C,H,O原子个数比为1∶2∶3 B、分子中C,H原子个数比为1∶2 C、有机物中必定含有氧 D、有机物中一定不含氧8. 某有机化合物只含C、H、O 三种元素且只含有一种官能团,其相对分子质量为58,该有机物完全燃烧时产生等物质的量的CO2和H2O.则它可能的结构共有(不考虑立体异构)( )A、3 种 B、4 种 C、5 种 D、6 种二、填空题
-
9. 某烃A的分子量为56,应用红外光谱测知分子中含有1个碳碳双键,应用核磁共振氢谱法检测显示只有二种类型的氢原子,写出A的分子式 , 结构简式 , 用系统命名法命名是 ;在A的同系物中分子量最小的烃的结构简式是 。10. 酒精在人体肝脏内可转化为多种有害物质,有机物A是其中的一种,对A的结构进行如下分析:
①通过样品的质谱分析测得A的相对分子质量为60;
②核磁共振氢原子光谱能对有机物分子中同性氢原子给出相同的峰值(信号),根据峰值(信号)可以确定分子中氢原子的种类和数目.例如:乙醇(CH3CH2OH)有三种氢原子(图1).经测定,有机物A的核磁共振氢谱示意图如图2:

③对A的水溶液进行测定发现该溶液pH<7.
根据以上分析,写出A的结构简式 .
三、实验探究题
-
11. 实验室可用NaBr、浓H2SO4、乙醇为原料制备少量溴乙烷:
C2H5—OH+HBr C2H5Br+H2O
已知反应物的用量为:0.30 mol NaBr(s);0.25 mol C2H5OH(密度为0.80 g/cm3);36 mL浓H2SO4(质量分数为98%,密度为1.84 g/mL);25 mL水。试回答下列问题:
(1)、该实验应选择下图中的a装置还是b装置?。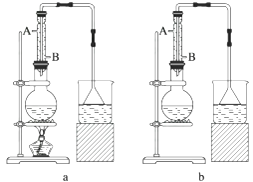 (2)、反应装置中的烧瓶应选择下列哪种规格最合适( )A、50 mL B、100 mL C、150 mL D、250 mL(3)、冷凝管中的冷凝水的流向应是( )A、A进B出 B、B进A出 C、从A进或B进均可(4)、实验完成后,须将烧瓶内的有机物蒸出,结果得到棕黄色的粗溴乙烷,欲得纯净溴乙烷,应采用的措施是
(2)、反应装置中的烧瓶应选择下列哪种规格最合适( )A、50 mL B、100 mL C、150 mL D、250 mL(3)、冷凝管中的冷凝水的流向应是( )A、A进B出 B、B进A出 C、从A进或B进均可(4)、实验完成后,须将烧瓶内的有机物蒸出,结果得到棕黄色的粗溴乙烷,欲得纯净溴乙烷,应采用的措施是四、综合题
-
12. 有机物A常用于食品行业.已知9.0g A在足量O2中充分燃烧,将生成的混合气体依次通过足量的浓硫酸和碱石灰,分别增重5.4g和13.2g,经检验剩余气体为O2 .(1)、A分子的质谱图如图所示,从图中可知其相对分子质量是90,则A的分子式是 .
 (2)、A能与NaHCO3溶液发生反应,A一定含有的官能团名称是 .(3)、A分子的核磁共振氢谱有4个峰,峰面积之比是1:1:1:3,则A的结构简式是 .(4)、0.1mol A与足量Na反应,在标准状况下产生H2的体积是L.(5)、A在一定条件下可聚合得到一种聚酯,用于制造手术缝合线,其反应的化学方程式是 .
(2)、A能与NaHCO3溶液发生反应,A一定含有的官能团名称是 .(3)、A分子的核磁共振氢谱有4个峰,峰面积之比是1:1:1:3,则A的结构简式是 .(4)、0.1mol A与足量Na反应,在标准状况下产生H2的体积是L.(5)、A在一定条件下可聚合得到一种聚酯,用于制造手术缝合线,其反应的化学方程式是 .
-