浙教版科学八年级下学期 3.3 化学方程式 提升练习
试卷更新日期:2018-04-12 类型:同步测试
一、单选题
-
1. 甲、乙两烧杯内盛有等质量、等质量分数的盐酸。将镁逐渐加入甲烧杯,铁逐渐加入乙烧杯,测量加入的金属质量m和相应的烧杯内物质质量变化量△M,画出△M—m曲线oac和obc的示意图,如图所示。根据图中信息,下列说法错误的是( )
 A、m1:m2=3:7 B、m1-△M1=m2-△M2 C、曲线obc表示的是乙烧杯中△M与m的变化关系 D、当甲烧杯内加入铁的质量为m2时,溶液中溶质不止一种2.
A、m1:m2=3:7 B、m1-△M1=m2-△M2 C、曲线obc表示的是乙烧杯中△M与m的变化关系 D、当甲烧杯内加入铁的质量为m2时,溶液中溶质不止一种2.下图是某化学反应的微观示意图。关于该化学反应的说法错误的是( )
 A、反应类型是分解反应 B、反应前后各元素化合价不变 C、反应前后两种原子的数目不变 D、反应物是由两种元素组成的化合物3. 正确反映对应变化关系的图象是( )A、
A、反应类型是分解反应 B、反应前后各元素化合价不变 C、反应前后两种原子的数目不变 D、反应物是由两种元素组成的化合物3. 正确反映对应变化关系的图象是( )A、 向一定质量的水中加入硝酸钾晶体
B、
向一定质量的水中加入硝酸钾晶体
B、 向一定量的氧化铜中通入一氧化碳气体并加热
C、
向一定量的氧化铜中通入一氧化碳气体并加热
C、 一定量的镁在空气中燃烧
D、
一定量的镁在空气中燃烧
D、 在盛有空气的密闭容器中点燃红磷
4. 推理是一种重要的化学思维方法,以下推理合理的是( )A、因为单质是由一种元素组成的,所以只含一种元素的物质一定是单质 B、因为蜡烛燃烧生成CO2和H2O,所以蜡烛组成中一定含有碳元素和氢元素 C、因为MnO2能加快H2O2的分解速率,所以MnO2也能加快H2O的分解速率 D、因为溶液均一、稳定,所以均一稳定的液体就是溶液5. 质量守恒定律是帮助我们认识化学反应实质的重要理论,在化学反应aA+bB═cC+dD 中,下列说法正确的是( )A、化学计量数a与b之和一定等于c与d之和 B、反应物A与B的质量比一定等于C与D是质量比 C、若A和C都是盐,则一定是复分解反应 D、若xgA与xgB反应生成C与D的质量之和不一定等于2xg6. 地质人员发现一种带螺纹的矿石,研究时发现该矿石能在氧气中燃烧,主要反应是4X+11O2 2Fe2O3+8SO2 . 下列有关说法中正确的是( )A、X的化学式是FeS B、炼铁时用该矿石作原料比赤铁矿更环保 C、该反应类型为置换反应 D、反应后氧元素的化合价发生了改变7. 已知化学反应A+B═C+D,A、B两物质完全反应时质量比为3:4,若生成C和D总质量为140g,则反应消耗B的质量为( )A、120 g B、100 g C、80 g D、60 g8. 二甲醚是一种重要的清洁燃料,可以代替氟利昂作制冷剂,对臭氧层没有破坏作用.工业制备二甲醚(CH3OCH3)的化学方程式为3CO+3H2═CH3OCH3+X,下列有关说法正确的是( )A、该反应为置换反应 B、X的化学式为CO2 C、二甲醚完全燃烧生成一氧化碳和水 D、二甲醚中碳、氢、氧元素的质量比为2:6:19. 在一密闭容器中,甲在氧气中充分燃烧生成二氧化碳和水,测得反应前后各物质质量如表
在盛有空气的密闭容器中点燃红磷
4. 推理是一种重要的化学思维方法,以下推理合理的是( )A、因为单质是由一种元素组成的,所以只含一种元素的物质一定是单质 B、因为蜡烛燃烧生成CO2和H2O,所以蜡烛组成中一定含有碳元素和氢元素 C、因为MnO2能加快H2O2的分解速率,所以MnO2也能加快H2O的分解速率 D、因为溶液均一、稳定,所以均一稳定的液体就是溶液5. 质量守恒定律是帮助我们认识化学反应实质的重要理论,在化学反应aA+bB═cC+dD 中,下列说法正确的是( )A、化学计量数a与b之和一定等于c与d之和 B、反应物A与B的质量比一定等于C与D是质量比 C、若A和C都是盐,则一定是复分解反应 D、若xgA与xgB反应生成C与D的质量之和不一定等于2xg6. 地质人员发现一种带螺纹的矿石,研究时发现该矿石能在氧气中燃烧,主要反应是4X+11O2 2Fe2O3+8SO2 . 下列有关说法中正确的是( )A、X的化学式是FeS B、炼铁时用该矿石作原料比赤铁矿更环保 C、该反应类型为置换反应 D、反应后氧元素的化合价发生了改变7. 已知化学反应A+B═C+D,A、B两物质完全反应时质量比为3:4,若生成C和D总质量为140g,则反应消耗B的质量为( )A、120 g B、100 g C、80 g D、60 g8. 二甲醚是一种重要的清洁燃料,可以代替氟利昂作制冷剂,对臭氧层没有破坏作用.工业制备二甲醚(CH3OCH3)的化学方程式为3CO+3H2═CH3OCH3+X,下列有关说法正确的是( )A、该反应为置换反应 B、X的化学式为CO2 C、二甲醚完全燃烧生成一氧化碳和水 D、二甲醚中碳、氢、氧元素的质量比为2:6:19. 在一密闭容器中,甲在氧气中充分燃烧生成二氧化碳和水,测得反应前后各物质质量如表物 质
甲
氧气
二氧化碳
水
反应前质量(g)
40
48
1
2
反应后质量(g)
待测
0
45
29
关于此反应,下列认识正确的是( )
A、该变化的基本反应类型一定是置换反应 B、甲中肯定含碳元素 C、待测等于23 D、参加反应的甲和二氧化碳的质量比为40:110. 下列化学方程式书写正确的是( )A、2P+5O2 P2O5 B、3Fe+2O2 Fe3O4 C、C+O2═CO2 D、H2SO4+NaOH═NaSO4+H2O二、填空题
-
11. 写出下列反应的符号表达式,并在括号内标明属于“化合反应”还是“分解反应”.
硫粉在空气中燃烧()
铁丝在氧气中燃烧()
过氧化氢和二氧化锰混合制氧气()
加热高锰酸钾制氧气().
12. 我国使用的燃料主要是煤炭和石油,产生的SO2遇到雨水成为酸雨.目前有一种较有效的方法,即用直升飞机喷洒碳酸钙粉末,脱硫效果可达85%,碳酸钙与SO2及空气中的氧反应生成硫酸钙和二氧化碳,写出化学方程式 .13. 配平下列方程式:(系数为1的不用填写)① C2H6+O2 CO2+H2O
② Fe3O4+Al Fe+Al2O3
③ Al+H2SO4=Al2(SO4)3+H2
④ NaOH+H2SO4=Na2SO4+H2O.
14. 根据化学方程式2H2O 2H2↑+O2↑,写出其意义:a.
b.
c.
15. 对于化学反应:2A=2B+C,已知:反应生成B和C的质量比为B∶C =1∶8。请填空:物质
A
B
C
反应前质量/g
100
0
5
反应后质量/g
64
16. 为了降低汽车尾气对空气的污染,可用纳米级的某种氧化物作催化剂,使尾气中的CO与氮氧化物(NOx)反应转化为空气中含有的两种气体(其中一种为单质),则该转化的化学方程式为:。17. Na2S2O3(硫代硫酸钠)和Ca(IO3)2是重要的化学试剂.(1)Na2S2O3中硫元素的化合价为 .与稀硫酸反应的化学方程式为:Na2S2O3+H2SO4=Na2SO4+S↓+X↑+H2O,则X物质的化学式为 .反应产物S在氧气中燃烧的现象是发出 火焰,产生一种 气味的气体.
(2)Ca(IO3)2是一种难溶于水的白色固体,可由碘酸钾(KIO3)溶液和氯化钙溶液进行复分解反应制得,则反应的化学方程式是 .
18. (1)某钢铁厂若需消耗500t含Fe2O396%的赤铁矿石,该厂理论上可产含Fe98%的生铁 t.(2)用上述得到的生铁与足量的废硫酸反应,可得硫酸亚铁的质量是 t.
三、解答题
-
19. 乙醇俗称酒精.可用作医用消毒,也常作燃料。(1)、乙醇不完全燃烧会产生一氧化碳,实验测得反应前后各物质的质量如下表:
物质
乙醇
氧气
二氧化碳
水
一氧化碳
反应前质量(g)
4.6
8.8
0
0
0
反应后质量(g)
0
0
6.6
a
1.4
①表中a的值为。
②该实验发生反应的化学方程式为: +CO
(2)、乙醇完全燃烧的化学方程式可表示为:求:92g乙醇完全燃烧需消耗多少g氧气?
20.解决问题常面临着方法的选择,面对不同的结果我们应继续探索。为得知15.8g高锰酸钾完全分解能产生多少克氧气,小柯与小妍分别采取了以下方法:

请回答:
(1)、在本实验条件下,氧气的密度为1.4×10一3g/mL,则由小柯的测量结果可算出15.8g高锰酸钾分解后所产生的氧气质量为g(结果保留一位小数)。(2)、老师提醒小柯,其实可以直接用天平测量出反应产生的气体质量,请简述该测量方案:。(3)、大家经过讨论,认为小妍的计算方法明显错误,本题不能采用该方法计算氧气质量的理由是________。A、高锰酸钾中含氧元素 B、锰酸钾和二氧化锰中含氧元素 C、氧气中含氧元素(4)、请在答卷上列式计算15.8g高锰酸钾完全分解所产生的氧气质量。(注意格式)(5)、若实验操作无误,不考虑实验中的误差,针对小柯的测定结果与你的计算结果,请提出一种合理的猜测:。21.某补钙药剂的标签主要内容如图所示,现测定该钙片含量是否符合标注,做如下实验:取10片该钙片,放入干燥、洁净的烧杯中,再向烧杯中加入50g某浓度稀盐酸,恰好完全反应(钙片中其他成分不溶于水,也不和稀盐酸反应,反应中产生的气体全部放出),反应后称量烧杯内剩余物质的质量为64.5g.求:
 (1)、反应中生成二氧化碳的质量;(2)、通过计算说明每片钙片实际钙含量.说明是否与标注相符?(3)、试计算所用稀盐酸的溶质质量分数.
(1)、反应中生成二氧化碳的质量;(2)、通过计算说明每片钙片实际钙含量.说明是否与标注相符?(3)、试计算所用稀盐酸的溶质质量分数.四、实验探究题
-
22. 结合下列实验装置图回答问题:
 (1)、写出指定仪器的名称:
(1)、写出指定仪器的名称:①;②
(2)、实验室常用醋酸钠固体与碱石灰固体共热来制取甲烷.甲烷常温下是一种无色、无味的气体,密度比空气小.极难溶于水的气体,现选择合适的装置来制取并收集,应该选择的发生装置是 , 收集装置是(3)、实验室用高锰酸钾制取氧气,实验结束后,发现水槽内的水变成了紫红色,可能的原因是(4)、如果用装满水的图F装置收集氢气,则氢气应从端(填“A”或“B”) 进入装置中(5)、化学兴趣小组的同学对某炼铁厂生产的生铁(杂质不与酸反应)进行组成分析.其实验数据如下表.实验步骤
相关数据
①称取生铁样品放入烧杯中
16g
②加入足量15%的盐酸
200.0g
③称取反应后烧杯中物质总质量
215.5g
根据表中数据,计算:
①产生氢气的是 g.
②生铁样品中铁的质量 .
23. 大理石(主要成分CaCO3)是重要的建筑材料.为了测定某大理石样品中杂质的含量,某实验小组准确称取100g样品,设计了如下实验方案:【实验一】将100g大理石样品放入硬质玻璃管中高温加热,在不同反应时间测得的实验数据如下表(大理石高温加热的反应方程式是:CaCO3 CaO+CO2↑,杂质不反应):
反应时间/min
0
5
9
12
15
剩余固体质量/g
100
91.2
73.6
64.8
64.8
(1)、100g大理石样品完全分解生成气体的质量是 g.(2)、100g大理石样品中杂质的质量是多少克?(写出计算过程)(3)、【实验二】将100g大理石样品放入一定量的稀盐酸中,充分反应后测得实验数据如如图(杂质不与稀盐酸反应,气体的溶解忽略不计):
根据实验及有关数据进行分析:
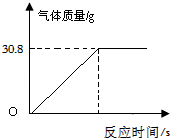
【实验小组根据实验二】数据计算出样品中杂质的质量为30g.经检查无计算原理及数字运算错误.请判断【实验二】的测定结果是否正确,如不正确要指出错误的原因.