山东省济南市商河县2017-2018学年九年级上学期化学期末考试试卷
试卷更新日期:2018-04-11 类型:期末考试
一、单选题
-
1. 2016杭州G20峰会的精彩文艺演出中,发生化学变化的是( )A、音乐喷泉 B、焰火表演 C、舞台升降 D、灯光表演2. “低碳”是一种生活习惯,是一种自然而然的去节约身边各种资源的习惯,下列做法不符合“低碳生活”理念的是( )A、教科书循环使用 B、尽量避免使用一次性餐具 C、夏天为了更凉快,把室内空调温度设置到很低 D、提倡乘坐公共交通工具、骑自行车或步行等出行方式3. 用分子的知识解释下列现象,正确的是( )A、缉毒犬能根据气味发现毒品,是由于分子不断运动 B、铁丝在空气中不燃烧而在氧气中能燃烧,说明空气和氧气中的氧分子化学性质不同 C、变瘪的乒乓球放入热水中能鼓起来,是由于分子受热体积变大 D、降温能使水结成冰,是因为在低温下水分子静止不动4. 济南市2017年11月20日空气质量报告:老城区空气污染指数为64,空气质量级别为Ⅱ级,空气质量状况为良,空气首要污染物为可吸入颗粒物,下列说法正确的是( )A、氧气的化学性质比较活泼,属于可燃物 B、减少燃煤的使用,有有效地减少可吸入颗粒物的排放 C、空气质量报告中所列的空气质量级别越大,空气质量越好 D、二氧化碳、二氧化硫、二氧化氮等气体在空气中含量增多会造成空气污染5. 市场上有“加碘食盐”、“高钙牛奶”、“含氟牙膏”等商品,这里的“碘、钙、氟”指的是( )A、单质 B、元素 C、分子 D、原子6. 在空气中含量较多且化学性质不活泼的气体是( )A、氧气 B、二氧化碳 C、氮气 D、水蒸气7. 加入足量水,能形成溶液的是( )
A、蔗糖 B、牛奶 C、果粒橙 D、豆浆8. 锗是重要的半导体材料。在元素周期表中,锗元素的信息如图所示,对图中信息解释不正确的是( ) A、原子序数为32 B、元素名称为锗 C、元素符号为Ge D、相对原子质量为329. 下列各微粒结构示意图中表示阳离子的是( )A、
A、原子序数为32 B、元素名称为锗 C、元素符号为Ge D、相对原子质量为329. 下列各微粒结构示意图中表示阳离子的是( )A、 B、
B、 C、
C、 D、
D、 10. 实验过程中要注意安全,下列实验操作安全的是( )A、为了快捷可直接把pH试纸放入待测液测溶液的pH B、点燃氢气前先检验其纯度 C、给试管内液体加热时试管口对着人 D、将鼻孔凑到容器口去闻药品的气味11. 下列实验操作正确的是( )A、
10. 实验过程中要注意安全,下列实验操作安全的是( )A、为了快捷可直接把pH试纸放入待测液测溶液的pH B、点燃氢气前先检验其纯度 C、给试管内液体加热时试管口对着人 D、将鼻孔凑到容器口去闻药品的气味11. 下列实验操作正确的是( )A、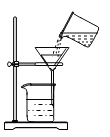 过滤
B、
过滤
B、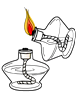 点燃酒精灯
C、
点燃酒精灯
C、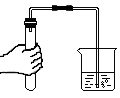 检查装置气密性
D、
检查装置气密性
D、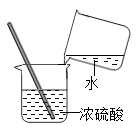 稀释浓硫酸
12. 将下列固体分别放入水中,溶液温度明显降低的是( )A、硝酸铵 B、生石灰 C、烧碱 D、食盐13. 2016年4月15日是我国首个“全民国家安全教育日”.下列说法错误的是( )A、煤矿的矿井要加强通风,防止发生爆炸 B、森林发生火灾,可用砍断树木形成隔离带 C、厨房天然气泄露,可打开抽油烟机排气 D、进入久未开启的地窖,要做灯火实验14. 铜与稀硝酸反应可产生一种气体X,方程式为3Cu+8HNO3═3Cu(NO3)2+2X↑+4H2O,则X的化学式是( )A、H2O B、NO C、Cu D、N215. 某两种物质在一定条件下能发生化学反应,其反应的微观示意图如图,则下列说法中,正确的是( )
稀释浓硫酸
12. 将下列固体分别放入水中,溶液温度明显降低的是( )A、硝酸铵 B、生石灰 C、烧碱 D、食盐13. 2016年4月15日是我国首个“全民国家安全教育日”.下列说法错误的是( )A、煤矿的矿井要加强通风,防止发生爆炸 B、森林发生火灾,可用砍断树木形成隔离带 C、厨房天然气泄露,可打开抽油烟机排气 D、进入久未开启的地窖,要做灯火实验14. 铜与稀硝酸反应可产生一种气体X,方程式为3Cu+8HNO3═3Cu(NO3)2+2X↑+4H2O,则X的化学式是( )A、H2O B、NO C、Cu D、N215. 某两种物质在一定条件下能发生化学反应,其反应的微观示意图如图,则下列说法中,正确的是( )
(说明:一种小球代表一种元素的原子)
A、图中的反应物都是化合物 B、该反应属于置换反应 C、该反应属于复分解反应 D、该反应不符合质量守恒定律16. 二氧化硫是造成酸雨的主要成分之一,二氧化硫排放到空气中溶于水生成亚硫酸(H2SO3),其中亚硫酸中硫元素(S)的化合价为( )A、+2 B、-2 C、+4 D、+617. 下列物质性质与其用途的对应关系不合理的是( )A、浓硫酸具有吸水性,用于干燥氧气 B、盐酸能与铁反应,用于除铁锈 C、干冰升华吸热,所以可用于人工降雨 D、氢氧化钙溶液呈碱性,用于改良酸性废水18. 大多数作物适宜在中性或接近中性的土壤中生长。经测定某土壤的pH为5.5,为使其更适宜植物生长,应在土壤中施加适量的( )A、氢氧化钠 B、熟石灰 C、食盐 D、盐酸19. 按酸、碱、盐、氧化物的顺序排列的一组物质是( )A、H2SO4、Na2CO3、NaCl、CuO B、H2O、Ca(OH)2、HCl、Na2SO4 C、H2SO4、NaOH、Na2CO3、Fe2O3 D、NaOH、H2CO3、NaCl、CO220. 下列有关利用海水的利用中:①海水“晒盐”;②海水“制碱”;③海水淡化;④从海水中提取镁,其中主要利用了化学变化的是( )A、全部是 B、只有② C、只有②④ D、①②③21. 欲除去氯化钙溶液中含有的少量盐酸,在不用指示剂的条件下,应加入的试剂是( )A、石灰石粉末 B、生石灰 C、石灰水 D、纯碱22. 下列试剂中,能把KOH溶液、稀硫酸、CaCl2溶液一次鉴别出来的是( )A、KCl溶液 B、K2CO3溶液 C、NaNO3溶液 D、稀盐酸23. 如图表示M、N两种不含结晶水的固体物质的溶解度曲线。根据图示判断,下列说法中,正确的是( ) A、M、N的溶解度都随温度的升高而增大 B、将t1℃时M的饱和溶液升温至t2℃,溶质的质量分数增大 C、在t1℃时,M、N的饱和溶液中溶质的质量分数二者相等 D、将t2℃时M、N的饱和溶液分别降温至t1℃,两溶液中均析出晶体24. X,Y,Z三种金属中,只有Z能与稀硫酸反应,当把Y放入X的盐溶液时,Y表面有X析出,则X,Y,Z三种金属的活动性顺序为( )A、X>Y>Z B、Z>X>Y C、Y>Z>X D、Z>Y>X
A、M、N的溶解度都随温度的升高而增大 B、将t1℃时M的饱和溶液升温至t2℃,溶质的质量分数增大 C、在t1℃时,M、N的饱和溶液中溶质的质量分数二者相等 D、将t2℃时M、N的饱和溶液分别降温至t1℃,两溶液中均析出晶体24. X,Y,Z三种金属中,只有Z能与稀硫酸反应,当把Y放入X的盐溶液时,Y表面有X析出,则X,Y,Z三种金属的活动性顺序为( )A、X>Y>Z B、Z>X>Y C、Y>Z>X D、Z>Y>X二、填空题
-
25. 选择H、O、C、Ca、Na、Cu六种元素中的适当元素,组成符合下列要求的物质,将化学式填写在空格中:(1)、一种可燃性的气体单质(2)、一种酸;(3)、一种难溶的碱;(4)、一种可溶性的盐。26. 请沿用科学家认识事物的方式认识“水”。
①从分类角度:蒸馏水(填“是”或“不是”)氧化物;
②从微观角度:构成水的微粒是(填名称);
③从变化角度:自来水厂净水过程中用到活性炭,其作用是。净水过程中常用液氯(Cl2)作消毒剂,液氯注入水后发生反应的微观示意图如下:

在上述反应前后,存在形态没有发生改变的元素是。
④从应用角度:生理盐水的溶剂为;
⑤从环保角度:提倡节约用水,保护水资源。不合理的做法是。
A.淘米水浇花
B.使用节水龙头
C.废水处理达标后排放
D.实验后的废液直接倒入下水道
三、实验题
-
27. 某校同学开展了如下“溶液酸碱性的检验”的实验活动:
 (1)、把自制的紫色紫薯汁按图1所示分别滴加到试管中,观察到的现象如下表所示:
(1)、把自制的紫色紫薯汁按图1所示分别滴加到试管中,观察到的现象如下表所示:溶液
白醋
盐酸
食盐水
草木灰水
石灰水
加入紫薯汁后的颜色
红色
红色
紫色
绿色
绿色
①图1中存放紫薯汁的仪器名称;
②据上表推测,紫薯汁能做酸碱指示剂,遇到稀硫酸溶液可能显示的颜色是 , 该汁液(填“能”或“不能”)做酸碱指示剂.
(2)、用pH试纸测定图1中部分溶液的酸碱度:草木灰水pH>7,属于(填“酸性”、“中性”或“碱性”)溶液,白醋pH(填“>”、”<”或”=”)7.(3)、图2是三位同学分别测定土壤酸碱度的操作示意图,其中正确的是(填“A”、“B”或“C”,下同),可能导致所测溶液pH数值发生改变的错误操作是 .28. 请用下列实验装置完成气体的制取及性质实验。 (1)、仪器a的名称 , b的名称。(2)、用双氧水和二氧化锰混合制氧气,为了得到平稳的氧气流,应该选择的发生装置是(填序号),反应的化学方程式为;当产生的氧气从D的左边导管通入时,很快看到G中导管口有气泡冒出。D中白磷始终没有燃烧的原因是 ;E中观察到的现象是 。(3)、实验过程中,F中反应的化学方程式为;G中溶液由紫色变红色,G中颜色变化的原因是(用化学方程式表示)。(4)、用H装置可以收集剩余气体,H装置收集气体的依据是。
(1)、仪器a的名称 , b的名称。(2)、用双氧水和二氧化锰混合制氧气,为了得到平稳的氧气流,应该选择的发生装置是(填序号),反应的化学方程式为;当产生的氧气从D的左边导管通入时,很快看到G中导管口有气泡冒出。D中白磷始终没有燃烧的原因是 ;E中观察到的现象是 。(3)、实验过程中,F中反应的化学方程式为;G中溶液由紫色变红色,G中颜色变化的原因是(用化学方程式表示)。(4)、用H装置可以收集剩余气体,H装置收集气体的依据是。四、简答题
-
29. 如图是氢氧化钠溶液和盐酸用滴加方式反应时,溶液pH随滴入溶液体积变化的曲线。
 (1)、氢氧化钠和盐酸恰好完全反应时,溶液的pH7(填“大于”或“小于”或“等于”),该反应的实质是。(2)、根据曲线判断,该反应是将(填“氢氧化钠溶液”或“盐酸”,下同)滴入中,理由是。(3)、当滴入溶液的体积为15mL时,所得溶液中的溶质为(写化学式),若在此溶液中滴入石蕊试液,溶液显色。30. 烧水的铝壶中常结有一层水垢(水垢的主要成分是CaCO3和Mg(OH)2),用适量的稀盐酸可以除去它,Mg(OH)2和稀盐酸反应的化学方程式是。若盐酸的用量过多,一段时间后会看到现象,会导致铝壶损坏,原因是(写反应的化学方程式)。
(1)、氢氧化钠和盐酸恰好完全反应时,溶液的pH7(填“大于”或“小于”或“等于”),该反应的实质是。(2)、根据曲线判断,该反应是将(填“氢氧化钠溶液”或“盐酸”,下同)滴入中,理由是。(3)、当滴入溶液的体积为15mL时,所得溶液中的溶质为(写化学式),若在此溶液中滴入石蕊试液,溶液显色。30. 烧水的铝壶中常结有一层水垢(水垢的主要成分是CaCO3和Mg(OH)2),用适量的稀盐酸可以除去它,Mg(OH)2和稀盐酸反应的化学方程式是。若盐酸的用量过多,一段时间后会看到现象,会导致铝壶损坏,原因是(写反应的化学方程式)。五、计算题
-
31. 苯甲酸钠(C7H5O2Na)是一种食品添加剂,广泛用于食品工业中。请计算:(1)、苯甲酸钠有种元素组成;(2)、C7H5O2Na相对分子质量是质量是;(3)、C7H5O2Na中碳、氧两种元素的质量比是;(4)、14.4g苯甲酸钠中含有钠元素的质量是。
六、综合题
-
32. 侯德榜的侯氏制碱法打破了当时西方国家对制碱技术的垄断,促进了世界制碱技术的发展。海水制得的纯碱往往含有少量的氯化钠(NaCl),某化学兴趣小组的同学通过实验来测定该纯碱样品中纯碱的质量分数,他们取12g纯碱样品放入烧杯中,逐滴加入稀盐酸至不再产生气泡为止,共消耗盐酸100g,烧杯中没有残留不溶物,称得反应后溶液的质量为107.6g,计算:(1)、侯氏制碱法中的碱是指纯碱,其化学式为 , 纯碱是一种盐,易溶于水,水溶液呈性。(2)、生成二氧化碳g;(3)、样品中纯碱的质量分数是多少?(要求写出计算过程,结果精确到0.1%)
-