2015-2016学年山东省泰安市高一下学期期末化学试卷
试卷更新日期:2016-12-01 类型:期末考试
一、选择题
-
1. 书法离不开文房四宝(笔、墨、纸、砚)做笔用的狼毫、研墨用的墨条、宣纸(即白纸)和做砚台用的砚石的主要成分依次是( )A、多糖、石墨、蛋白质、无机盐 B、塑料、石墨、多糖、无机盐 C、蛋白质、炭黑、多糖、无机盐 D、蛋白质、煤炭、多糖、有机玻璃2. 16O和18O是氧元素的两种核素,NA表示阿伏加德罗常数的数值.下列说法正确的是( )A、16O和18O的质量数相同,但是中子数不同 B、16O和18O核外电子排布不同 C、通过化学变化可以实现16O与18O间的相互转化 D、标准状况下,1.12L16O2和1.12L18O2均含0.1NA个氧原子3. 一种“即食即热型快餐”适合外出旅行时使用.其内层是用铝箔包裹的、并已加工好的真空包装食品,外层则是分别包装的两包化学物质,使用时拉动预留在外的拉线,使这两种化学物质反应,此时便可对食物进行加热,这两包化学物质最合适的选择是( )A、浓硫酸与水 B、生石灰与水 C、熟石灰与水 D、氯化钠与水4. 如图表示某有机反应,该反应的类型为( )
 A、加成反应 B、取代反应 C、氧化反应 D、化合反应5. 有5种单核粒子,它们分别是4018□、4019□、4019□+、4020□2+、4120□(□内元素符号未写出),则它们所属元素的种类有( )A、2种 B、3种 C、4种 D、5种6. 微量元素硒(Se)对人体有保健作用,我国鄂西地区含有丰富的硒矿资源.已知硒与氧同主族,与钾同周期,下列有关硒元素的性质描述错误的是( )A、硒的氢化物以H2Se形式存在 B、硒的氧化物以Se2O3形式存在 C、硒的氢化物的热稳定性比硫化氢差 D、硒的最高价氧化物的水化物的化学式是H2SeO47. 某烷烃分子量为72,跟氯气反应生成的一氯代物只有一种,该烷烃的结构简式是( )A、CH3CH2CH3 B、
A、加成反应 B、取代反应 C、氧化反应 D、化合反应5. 有5种单核粒子,它们分别是4018□、4019□、4019□+、4020□2+、4120□(□内元素符号未写出),则它们所属元素的种类有( )A、2种 B、3种 C、4种 D、5种6. 微量元素硒(Se)对人体有保健作用,我国鄂西地区含有丰富的硒矿资源.已知硒与氧同主族,与钾同周期,下列有关硒元素的性质描述错误的是( )A、硒的氢化物以H2Se形式存在 B、硒的氧化物以Se2O3形式存在 C、硒的氢化物的热稳定性比硫化氢差 D、硒的最高价氧化物的水化物的化学式是H2SeO47. 某烷烃分子量为72,跟氯气反应生成的一氯代物只有一种,该烷烃的结构简式是( )A、CH3CH2CH3 B、 C、
C、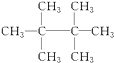 D、
D、 8. 如图是制取和收集某气体的实验装置,该装置可用于( )
8. 如图是制取和收集某气体的实验装置,该装置可用于( ) A、用浓盐酸和二氧化锰反应制取Cl2 B、用浓硝酸与铜反应制取NO2 C、用过氧化钠固体和水反应制取O2 D、用浓氨水和生石灰反应制取NH39. 下列各分子中所有原子的最外电子层均达到8电子稳定结构的是( )A、N2 B、HClO C、CH4 D、BF310. 如图是某课外活动小组设计的用化学电池使LED灯发光的装置.下列说法错误的是( )
A、用浓盐酸和二氧化锰反应制取Cl2 B、用浓硝酸与铜反应制取NO2 C、用过氧化钠固体和水反应制取O2 D、用浓氨水和生石灰反应制取NH39. 下列各分子中所有原子的最外电子层均达到8电子稳定结构的是( )A、N2 B、HClO C、CH4 D、BF310. 如图是某课外活动小组设计的用化学电池使LED灯发光的装置.下列说法错误的是( ) A、铜片表面有气泡生成 B、装置中存在“化学能→电能→光能”的转换 C、如果将铜片换成铁片,电路中的电流方向将改变 D、如果将铜片换成银片,LED灯仍正常发光
A、铜片表面有气泡生成 B、装置中存在“化学能→电能→光能”的转换 C、如果将铜片换成铁片,电路中的电流方向将改变 D、如果将铜片换成银片,LED灯仍正常发光二、选择题
-
11. 某短周期非金属元素的原子核外最外层电子数是次外层电子数的一半,该元素( )A、在自然界中只以化合态的形式存在 B、单质常用作半导体材料和光导纤维 C、最高价氧化物不与酸反应 D、气态氢化物比甲烷稳定12. 向甲、乙、丙、丁四个容积相同的密闭容器中分别充入一定量的SO2和O2 , 开始反应时,按反应速率由大到小的顺序排列正确的是( )
甲.在500℃时,10mol SO2和5mol O2反应
乙.在500℃时,用V2O5做催化剂,10mol SO2和5mol O2反应
丙.在450℃时,8mol SO2和5mol O2反应
丁.在500℃时,8mol SO2和5mol O2反应.
A、甲、乙、丙、丁 B、乙、甲、丙、丁 C、乙、甲、丁、丙 D、丁、丙、乙、甲13. 下列叙述正确的是( )A、汽油、柴油和植物油都是碳氢化合物 B、乙醇可以被氧化为乙酸,二者都能发生酯化反应 C、甲烷、乙烯和苯在工业上都可通过石油分馏得到 D、含5个碳原子的有机物.每个分子中最多可形成4个C﹣C单键14. 下列涉及有机物的性质或应用的说法不正确的是( )A、干馏煤可以得到甲烷、苯和氨等重要化工原料 B、用于奥运“祥云”火炬的丙烷是一种清洁燃料 C、用大米酿的酒在一定条件下密封保存,时间越长越香醇 D、纤维素、蔗糖、葡萄糖和脂肪在一定条件下都可发生水解反应15. 在A(g)+B(g)═C(g)+D(g)的反应体系中,C的百分含量和时间的关系如图所示,若反应分别在400℃和100℃下进行,所得曲线分别为Q与P,则正反应是放热反应的图为( )A、 B、
B、 C、
C、 D、
D、 16.
16.二噁英是一类物质的统称,这类物质的母体是
 ,其中苯环上的氢原子如果被氯原子取代,所得物质的毒性是KCN的100倍.当两个氯原子取代苯环上的氢时,所得同分异构体的数目是( )A、7种 B、8种 C、9种 D、10种17. 几种短周期元素的原子半径及主要化合价如表所示:
,其中苯环上的氢原子如果被氯原子取代,所得物质的毒性是KCN的100倍.当两个氯原子取代苯环上的氢时,所得同分异构体的数目是( )A、7种 B、8种 C、9种 D、10种17. 几种短周期元素的原子半径及主要化合价如表所示:元素代号
X
Y
Z
W
原子半径/pm
160
143
70
66
主要化合价
+2
+3
+5 +3 ﹣3
﹣2
下列叙述正确的是( )
A、X,Y元素的金属性:X<Y B、一定条件下,Z单质与W的常见单质直接生成ZW2 C、一定条件下,W单质可以将Z单质从其氢化物中置换出来 D、Y的最高价氧化物对应的水化物能溶于稀氨水18. 根据反应:2Ag++Cu═Cu2++2Ag,设计如图所示原电池,下列说法错误的是( ) A、X可以是银或石墨 B、电子从铜电极经外电路流向X电极 C、Y是硫酸铜溶液 D、X极上的电极反应式为Ag++e﹣═Ag19. 下列有关物质结构和元素周期律的表述正确的是( )A、主族元素的最高正价均等于其族序数 B、第2周期第ⅣA族元素的原子,核电荷数和中子数均为6 C、第ⅦA族元素是同周期中非金属性最强的元素 D、非金属元素的气态氢化物溶于水后,水溶液均呈酸性20. 将V1 mL 1.0mol/L HCl溶液和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,结果如图所示(实验中始终保持V1+V2=50mL).下列叙述正确的是( )
A、X可以是银或石墨 B、电子从铜电极经外电路流向X电极 C、Y是硫酸铜溶液 D、X极上的电极反应式为Ag++e﹣═Ag19. 下列有关物质结构和元素周期律的表述正确的是( )A、主族元素的最高正价均等于其族序数 B、第2周期第ⅣA族元素的原子,核电荷数和中子数均为6 C、第ⅦA族元素是同周期中非金属性最强的元素 D、非金属元素的气态氢化物溶于水后,水溶液均呈酸性20. 将V1 mL 1.0mol/L HCl溶液和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,结果如图所示(实验中始终保持V1+V2=50mL).下列叙述正确的是( ) A、做该实验时环境温度为22℃ B、该实验表明化学能可以转化为热能 C、NaOH溶液的浓度约是1.00 mol/L D、该实验表明有水生成的反应都是放热反应
A、做该实验时环境温度为22℃ B、该实验表明化学能可以转化为热能 C、NaOH溶液的浓度约是1.00 mol/L D、该实验表明有水生成的反应都是放热反应三、综合题
-
21. 在①178O、1②188O、③2311Na、④2412Mg、⑤146C、⑥147N中:(1)、 和互为同位素(填序号,下同);(2)、 和的质量数相等,但不能互称同位素;(3)、 和的中子数相等,但质子数不等,所以不是同一种元素.22. 短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等,请回答下列问题:
 (1)、W在周期表中的位置是 , Q、R、T三种元素原子半径由大到小顺序为(用元素符号表示),Q的最高价氧化物的电子式为 , R氢化物分子的结构式为 .(2)、元素的原子得电子能力:QW(填“强于”或“弱于”).(3)、原子序数比R多1的元素有一种氢化物能分解为它的另一种氢化物,该反应的化学方程式为 .23. 20世纪30年代,Eyring和Pzer在碰撞理论的基础上提出化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成的,而是在反应物到生成物的过程中经过一个高能量的过渡态.如图是H2O和CO反应生成CO2和H2过程中的能量变化示意图.由图可知,CO2和H2的总能量(填“大于”、“小于”或“等于”)H2O和CO的总能量,则该反应是(填“吸热”或“放热”)反应.
(1)、W在周期表中的位置是 , Q、R、T三种元素原子半径由大到小顺序为(用元素符号表示),Q的最高价氧化物的电子式为 , R氢化物分子的结构式为 .(2)、元素的原子得电子能力:QW(填“强于”或“弱于”).(3)、原子序数比R多1的元素有一种氢化物能分解为它的另一种氢化物,该反应的化学方程式为 .23. 20世纪30年代,Eyring和Pzer在碰撞理论的基础上提出化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成的,而是在反应物到生成物的过程中经过一个高能量的过渡态.如图是H2O和CO反应生成CO2和H2过程中的能量变化示意图.由图可知,CO2和H2的总能量(填“大于”、“小于”或“等于”)H2O和CO的总能量,则该反应是(填“吸热”或“放热”)反应. 24. 一定温度下,在容积为VL的密闭容器中进行反应:aN(g)═bM(g),M、N的物质的量随时间的变化曲线如图所示.
24. 一定温度下,在容积为VL的密闭容器中进行反应:aN(g)═bM(g),M、N的物质的量随时间的变化曲线如图所示. (1)、该反应的化学方程式中 = .(2)、t1~t2时间段,以M的浓度变化表示的平均反应速率为 .(3)、t2时,生成M的速率与消耗N的速率(填“相等”或“不相等”).(4)、下列叙述中能说明上述反应达到平衡状态的是 .A、反应中M与N的物质的量之比为1:1 B、混合气体的总物质的量不随时间的变化而变化 C、单位时间内每消耗a mol N,同时生成b mol M D、N的质量分数在混合气体中保持不变.25. 有机物A是一种重要的工业原料,其结构简式如图:
(1)、该反应的化学方程式中 = .(2)、t1~t2时间段,以M的浓度变化表示的平均反应速率为 .(3)、t2时,生成M的速率与消耗N的速率(填“相等”或“不相等”).(4)、下列叙述中能说明上述反应达到平衡状态的是 .A、反应中M与N的物质的量之比为1:1 B、混合气体的总物质的量不随时间的变化而变化 C、单位时间内每消耗a mol N,同时生成b mol M D、N的质量分数在混合气体中保持不变.25. 有机物A是一种重要的工业原料,其结构简式如图:
试回答下列问题:
(1)、有机物A的分子式为;(2)、有机物A中含有的含氧官能团名称是;(3)、0.5mol 该物质与足量金属钠反应,能生成标准状况下的氢气 L;(4)、该物质能发生的反应有(填序号).①能与NaOH溶液反应②能与溴的四氯化碳溶液反应
③能与甲醇发生酯化反应④可以燃烧
⑤能发生水解反应.
26. 乙烯的产量可以用来衡量一个国家的石油化工发展水平.请回答下列问题:(1)、可以用来鉴别甲烷和乙烯的试剂是 .A、水 B、稀硫酸 C、溴水 D、酸性高锰酸钾溶液(2)、在一定条件下,乙烯能与水反应生成有机物A,则A的结构简式是 .(3)、某同学在学习A的知识后,设计了如下实验.操作步骤为:①在试管里加入2mL A;
②把一端弯成螺旋状的铜丝放在酒精灯外焰中加热;
③立即将铜丝插入盛有A的试管里,反复操作几次;
④闻生成物的气味,观察铜丝表面的变化.
第④步操作中,铜丝表面的变化是;写出第③步操作中发生反应的化学方程式:
(4)、A在一定条件下可以被氧化成乙酸,用化学方程式说明乙酸和碳酸的酸性强弱: .27. 为了证明在实验室制备Cl2的过程中会有水蒸气和HCl挥发出来,甲同学设计了如图所示的实验装置,按要求回答问题: (1)、请根据甲同学的意图,连接相应的装置,接口顺序:b接 , 接 , 接a.(2)、U形管中所盛试剂为 .(3)、装置③中CCl4的作用是 .(4)、乙同学认为甲同学的实验有缺陷,不能证明最终通入AgNO3溶液中的气体只有一种,为了确保实验结论的可靠性,证明最终通入AgNO3溶液中的气体只有一种,乙同学提出在装置③之后再连接一个装置③.当观察到现象时,确保结论正确.丙同学看到甲同学设计的装置后提出无需多加装置,只需将原来烧杯中的AgNO3溶液换成其他溶液.你认为可将溶液换成 , 如果观察到的现象,则证明制Cl2时有HCl挥发出来.
(1)、请根据甲同学的意图,连接相应的装置,接口顺序:b接 , 接 , 接a.(2)、U形管中所盛试剂为 .(3)、装置③中CCl4的作用是 .(4)、乙同学认为甲同学的实验有缺陷,不能证明最终通入AgNO3溶液中的气体只有一种,为了确保实验结论的可靠性,证明最终通入AgNO3溶液中的气体只有一种,乙同学提出在装置③之后再连接一个装置③.当观察到现象时,确保结论正确.丙同学看到甲同学设计的装置后提出无需多加装置,只需将原来烧杯中的AgNO3溶液换成其他溶液.你认为可将溶液换成 , 如果观察到的现象,则证明制Cl2时有HCl挥发出来.四、计算题
-
28. 取标准状况下CH4和过量O2的混合气体840mL,点燃,将燃烧后的气体用过量碱石灰吸收,碱石灰增重0.600g.请计算:(1)、碱石灰吸收后所剩气体的体积(标准状况下);(2)、原混合气体中CH4与O2的体积比.