2015-2016学年山东省济宁市高一下学期期末化学试卷
试卷更新日期:2016-12-01 类型:期末考试
一、选择题
-
1. 下列有关说法正确的是( )A、蛋白质和油脂都属于高分子化合物,一定条件下都能水解 B、医疗上可用硫酸钡作x射线透视肠胃的内服药,是因为硫酸钡不溶于水 C、用过滤的方法从碘的四氯化碳溶液中获得碘 D、用浓硫酸配制一定物质的量浓度的稀硫酸时,浓硫酸溶于水后,应冷却至室温才能转移到容量瓶中2. 用NA表示阿伏加德罗常数,下列说法正确的是( )A、1mol乙烯分子中含有共用电子对数为6NA B、常温常压下,32gO2、O3的混合物含有Na个氧原子 C、标准状况下,2.24 L CH2Cl2含有的分子数等于0.1 NA D、7.1 g Cl2与足量NaOH溶液反应转移0.2×6.02×1023个电子3. 已知放射性元素 Ir位于元素周期表中第六周期第Ⅷ族,下列关于 Ir的说法正确的是( )A、铱为非金属元素 B、 Ir中子数与质子数的差为38 C、铱元素与碘元素位于同一周期 D、 Ir核外含有115个电子4. 下列离子方程式正确的是( )A、铁与稀盐酸反应:2Fe+6H+═2Fe3++3H2↑ B、在过氧化钠中加入稀硫酸:O22﹣+4H+═2H2O+O2↑ C、澄清石灰水与过量的小苏打溶液反应:Ca2++2OH﹣+2HCO3﹣═CaCO3↓+2H2O+CO32﹣ D、氢氧化钡溶液与稀硫酸反应:Ba2++SO42﹣═BaSO4↓5. 元素X,Y,Z原子序数之和为37,X,Y在同一周期,X+与Z﹣具有相同的核外电子层结构.下列推测不正确的是( )A、同周期元素中X的金属性最强 B、原子半径X>Y,离子半径X+>Z﹣ C、同族元素中Z的氢化物稳定性最高 D、同周期元素中Y的最高价含氧酸的酸性最强6. 下列对相应有机物的描述完全正确的是( )
①甲烷:天然气的主要成分,能发生取代反应
②乙烯:其产量是衡量一个国家石油化工发展水平的标志,可以发生加成反应
③苯:平面结构,每个分子中含有3个碳碳双键
④乙醇:可以用金属钠检验乙醇中是否含有水
⑤淀粉:属于糖类物质,遇碘元素变蓝色
⑥蛋白质:可通过烧焦的特殊气味进行鉴别,水解的最终产物为氨基酸.
A、①②③ B、②④⑥ C、①⑤⑥ D、①②⑥7. 工业上利用氢气在氯气中燃烧,所得产物再溶于水的方法制得盐酸,流程复杂且造成能量浪费.有人设想利用原电池原理直接制盐酸的同时,获取电能,假设这种想法可行,下列说法肯定错误的是( )A、通入氢气的电极为原电池的正极 B、两极材料都用石墨,用稀盐酸做电解质溶液 C、电解质溶液中的阳离子向通氯气的电极移动 D、通氯气的电极反应式为Cl2+2e﹣═2Cl﹣8. 将 4molA气体和3molB气体在2L的容器中混合并在一定条件下发生如下反应:2A(g)+B(g)⇌2C(g),若经 2s后测得 C的浓度为 0.6mol•L﹣1 , 现有下列几种说法:
①用物质A 表示反应的平均速率为 0.3mol•L﹣1•s﹣1
②物质 B的体积分数是40%
③2s 时物质 A 的转化率为30%
④2s 时物质 B 的浓度为 1.0mol•L﹣1
其中正确的是( )
A、①④ B、②③ C、①③ D、③④9. 对于可逆反应4NH3(g)+5O2(g)⇌4NO(g)+6H2O(g),下列叙述正确的是( )A、NH3和H2O化学反应速率关系是2v正(NH3)=3v正(H2O) B、达到化学平衡时,4v正(O2)=5v逆(NO) C、达到化学平衡时,若增加容器体积,则正反应速率减少,逆反应速率增大 D、若单位时间内生成x mol NO的同时,消耗x mol NH3 , 则反应达到平衡状态10. 为探究NaHCO3、Na2CO3与1mol/L盐酸反应(设两反应分别是反应Ⅰ、反应Ⅱ)过程中的热效应,进行实验并测得如下数据:下列有关说法正确的是( )序号
液体
固体
混合前温度
混合后最高温度
①
35mL水
2.5g NaHCO3
20℃
18.5℃
②
35mL水
3.2g Na2CO3
20℃
24.3℃
③
35mL盐酸
2.5g NaHCO3
20℃
16.2℃
④
35mL盐酸
3.2g Na2CO3
20℃
25.1℃
A、仅通过实验③即可判断反应Ⅰ是吸热反应 B、仅通过实验④即可判断反应Ⅱ是放热反应 C、通过实验可判断出反应Ⅰ、Ⅱ分别是吸热反应、放热反应 D、通过实验可判断出反应Ⅰ、Ⅱ分别是放热反应、吸热反应11. 下列有关化学键的叙述,正确的是( )A、离子化合物中一定只含有离子键 B、单质分子中均存在化学键 C、仅含有共价键的化合物一定是共价化合物 D、由不同种非金属元素的原子形成的共价化合物一定只含极性键12. 某有机物的结构简式如图:则此有机物可发生的反应类型有( )①取代 ②加成 ③氧化 ④酯化⑤中和.
 A、①②③④ B、②③④⑤ C、②③⑤ D、①②③④⑤13. 海洋中有丰富的食品、矿产、能源、药物和水产资源.下图是从海水中提取某些原料的.
A、①②③④ B、②③④⑤ C、②③⑤ D、①②③④⑤13. 海洋中有丰富的食品、矿产、能源、药物和水产资源.下图是从海水中提取某些原料的.
下列有关说法正确的是( )
A、第①步中除去粗盐中的SO42﹣、Ca2+、Mg2+、Fe3+等杂质,加入的药品顺序为:Na2CO3溶液→NaOH溶液→BaCl2溶液﹣→过滤后加盐酸 B、从第③步到第⑤步的目的是浓缩、富集溴 C、第①到第⑤步中,涉及到氧化还原反应共有2步 D、第④步中,SO2起氧化作用14. 根据侯氏制碱原理制备少量NaHCO3的实验,经过制取氨气、制取NaHCO3、分离NaHCO3、干燥NaHCO3四个步骤,下列图示装置和原理能达到实验目的是( )A、 制取氨气
B、
制取氨气
B、 制取NaHCO3
C、
制取NaHCO3
C、 分离NaHCO3
D、
分离NaHCO3
D、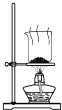 干燥NaHCO3
15. 已知:还原性强弱:I﹣>Fe2+ . 往100mL碘化亚铁溶液中缓慢通入2.24L(标准状况)氯气,反应完成后溶液中有一半的Fe2+被氧化成Fe3+ . 则原碘化亚铁溶液的物质的量浓度为( )A、0.6 mol•L﹣1 B、0.8 mol•L﹣1 C、1.0 mol•L﹣1 D、1.2 mol•L﹣116. 将22.4g铁粉逐渐加入到含HNO3 0.8mol的稀硝酸中,反应生成的气体的物质的量(x)随消耗铁粉的物质的量(y)变化关系中正确的是( )A、
干燥NaHCO3
15. 已知:还原性强弱:I﹣>Fe2+ . 往100mL碘化亚铁溶液中缓慢通入2.24L(标准状况)氯气,反应完成后溶液中有一半的Fe2+被氧化成Fe3+ . 则原碘化亚铁溶液的物质的量浓度为( )A、0.6 mol•L﹣1 B、0.8 mol•L﹣1 C、1.0 mol•L﹣1 D、1.2 mol•L﹣116. 将22.4g铁粉逐渐加入到含HNO3 0.8mol的稀硝酸中,反应生成的气体的物质的量(x)随消耗铁粉的物质的量(y)变化关系中正确的是( )A、 B、
B、 C、
C、 D、
D、
二、解答题
-
17. 实验室需要0.1mol•L﹣1 NaOH溶液450mL.回答下列问题:
 (1)、如图所示的仪器中配制溶液肯定不需要的是(填序号),配制上述溶液还需用到的玻璃仪器是(填仪器名称).(2)、在配制NaOH溶液时:
(1)、如图所示的仪器中配制溶液肯定不需要的是(填序号),配制上述溶液还需用到的玻璃仪器是(填仪器名称).(2)、在配制NaOH溶液时:①根据计算用托盘天平称取NaOH的质量为 g;
②若NaOH溶液在转移至容量瓶时,洒落了少许,则所得溶液浓度 0.1mol/L(填“>”、“<”或“=”);
③若NaOH固体溶解后立即移入容量瓶→洗烧杯→洗涤液移入容量瓶→定容,则所得溶液浓度 0.1mol•L﹣1(填“>”、“<”或“=”).
18. 有两个实验小组的同学为探究过氧化钠与二氧化硫反应,都用如图所示的装置进行实验.通入SO2气体,将带余烬的木条插入试管C中,木条复燃.
请回答下列问题:
(1)、第1小组同学认为Na2O2与SO2反应生成了Na2SO3和O2 , 该反应的化学方程式是(2)、请设计一种实验方案证明Na2O2与SO2反应生成的白色固体中含有Na2SO3 .(3)、第2小组同学认为Na2O2与SO2反应除了生成Na2SO3和O2外,还有Na2SO4生成.为检验是否有Na2SO4生成,他们设计了如下方案:[将B中反应后的固体溶于水] [白色固体] [仍有部分白色沉淀不溶解,证明有Na2SO4]上述方案是否合理?(填“合理”或“不合理”).
请简要说明两点理由:①; ② .
19. 四种短周期元素A、B、C、D的性质或结构信息如下:信息:①原子半径:A>B>C>D②四种元素之间形成的某三种分子的比例模型及部分性质如下:
甲:
 是地球上最常见的物质之一,是所有生命体生存的重要资源,约占人体体重的三分之二.
是地球上最常见的物质之一,是所有生命体生存的重要资源,约占人体体重的三分之二.乙:
 无色,无气味并且易燃.是常见的一种基础能源.
无色,无气味并且易燃.是常见的一种基础能源.丙:
 有强氧化性的弱酸,可以用于消毒杀菌.
有强氧化性的弱酸,可以用于消毒杀菌.请根据上述信息回答下列问题.
(1)、B元素在元素周期表中的位置为 , 请写出BC2分子的电子式: .(2)、A所在周期中,E元素的单质还原性最强,F元素的某些盐类常用作净水剂.E单质与甲反应有化合物X生成.请写出以下两个反应的离子方程式:①A元素的单质与物质甲发生反应: .
②F、C两种元素组成的化合物Y可作为高温结构陶瓷材料,X与Y两种化合物在溶液中发生反应: .
(3)、物质丁的元素组成和甲相同,丁分子具有18电子结构.向盛有一定浓度丁溶液的试管中,逐滴加入硫酸酸化的硫酸亚铁溶液.滴加过程中的现象为:①试管中溶液变成深棕黄色,发生反应的离子方程式为;
②开始有少量气泡出现(经验证是氧气),片刻后反应变得剧烈,继续滴加溶液,静置一段时间,试管底部出现红褐色沉淀.请回答“片刻后反应变得剧烈”的原因是ab .
20. 乙烯是一种重要的基本化工原料,以它为原料还可以合成很多的化工产品.现有以下转化如图1: (1)、聚乙烯的结构简式为;(2)、写出以下反应的化学方程式和反应类型:
(1)、聚乙烯的结构简式为;(2)、写出以下反应的化学方程式和反应类型:② , 反应类型是
③ , 反应类型是
(3)、实验室用如图2装置制备乙酸乙酯:试管中碎瓷片的作用是;导管a的作用是导气和;试管b内饱和Na2CO3溶液的作用一方面是除去乙酸乙酯中混有的乙酸和乙醇,另一方面是 .
21. 如图是由常见元素组成的一些单质及其化合物之间的转化关系图.各方框表示有关的一种反应物或生成物(部分物质已经略去).其中A、B、D在常温下均为无色无味的气体,C是能使湿润的红色石蕊试纸变蓝的气体,M是最常见的无色液体. (1)、写出C→E的化学方程式: .(2)、实验室常用加热两种固体混合物的方法制备物质C,其化学方程式为: , 干燥C常用(填写试剂名称).(3)、E物质遇到D物质时,会观察到现象,若用排水法收集F,则最终集气瓶中收集到的气体为(填写物质的化学式).(4)、写出F→G的离子方程式: .22. 用广谱高效的二氧化氯(ClO2)替代液氯进行消毒,可避免产生对人体健康有害的有机氯代物.(1)、二氧化氯(ClO2)是目前国际上公认的第四代高效、无毒的广谱消毒剂,它可由KClO3在H2SO4存在下与Na2SO3反应制得.请写出反应的离子方程式: .(2)、漂白剂亚氯酸钠(NaClO2)在常温黑暗处可保存一年,亚氯酸不稳定可分解,反应的离子方程式为:HClO2→ClO2↑+H++Cl﹣+H2O(未配平).当1molHClO2发生分解反应时,转移的电子个数是 .(3)、有效氯含量是含氯消毒剂的一个重要指标,有效氯含量的定义为:从HI中氧化出相同量的I2所需Cl2的质量与指定含氯消毒剂的质量之比,常用百分数表示.则ClO2的有效氯含量是 .
(1)、写出C→E的化学方程式: .(2)、实验室常用加热两种固体混合物的方法制备物质C,其化学方程式为: , 干燥C常用(填写试剂名称).(3)、E物质遇到D物质时,会观察到现象,若用排水法收集F,则最终集气瓶中收集到的气体为(填写物质的化学式).(4)、写出F→G的离子方程式: .22. 用广谱高效的二氧化氯(ClO2)替代液氯进行消毒,可避免产生对人体健康有害的有机氯代物.(1)、二氧化氯(ClO2)是目前国际上公认的第四代高效、无毒的广谱消毒剂,它可由KClO3在H2SO4存在下与Na2SO3反应制得.请写出反应的离子方程式: .(2)、漂白剂亚氯酸钠(NaClO2)在常温黑暗处可保存一年,亚氯酸不稳定可分解,反应的离子方程式为:HClO2→ClO2↑+H++Cl﹣+H2O(未配平).当1molHClO2发生分解反应时,转移的电子个数是 .(3)、有效氯含量是含氯消毒剂的一个重要指标,有效氯含量的定义为:从HI中氧化出相同量的I2所需Cl2的质量与指定含氯消毒剂的质量之比,常用百分数表示.则ClO2的有效氯含量是 .