2015-2016学年青海师大二附中高一下学期期末化学试卷
试卷更新日期:2016-12-01 类型:期末考试
一、选择题
-
1. 有机物
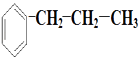 的一氯代物可能的结构有(不考虑立体异构)( ) A、5种 B、6种 C、7种 D、8种2. 下列有关烷烃的叙述中,正确的是( )
的一氯代物可能的结构有(不考虑立体异构)( ) A、5种 B、6种 C、7种 D、8种2. 下列有关烷烃的叙述中,正确的是( )①在烷烃分子中,所有的化学键都是单键
②烷烃中除甲烷外,很多都能使酸性KMnO4溶液的紫色褪去
③分子通式为CnH2n+2的烃不一定是烷烃
④所有的烷烃在光照条件下都能与氯气发生取代反应
⑤光照条件下,乙烷通入溴水中,可使溴水褪色.
A、①③⑤ B、②③ C、①④ D、①②④3. 有8种物质:①甲烷;②苯;③聚乙烯;④苯乙烯;⑤环己烷;⑥环己烯;⑦乙醇,既能使酸性高锰酸钾溶液褪色又能与溴水反应使之褪色的有( )A、4种 B、3种 C、2种 D、1种4. 乙苯催化脱氢制苯乙烯反应: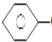 CH2CH3(g)⇌
CH2CH3(g)⇌ 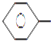 CH=CH2(g)+H2(g)下列说法中不正确的是( ) A、乙苯的一氯代物共有3种不同结构 B、苯乙烯和氢气生成乙苯的反应属于加成反应 C、苯乙烯分子中所有原子有可能位于同一平面上 D、等质量的苯和苯乙烯燃烧耗氧量相同5. 下列物质一定表示一种纯净物的是( )A、C5H12 B、C4H10 C、
CH=CH2(g)+H2(g)下列说法中不正确的是( ) A、乙苯的一氯代物共有3种不同结构 B、苯乙烯和氢气生成乙苯的反应属于加成反应 C、苯乙烯分子中所有原子有可能位于同一平面上 D、等质量的苯和苯乙烯燃烧耗氧量相同5. 下列物质一定表示一种纯净物的是( )A、C5H12 B、C4H10 C、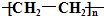 D、CHCl3
6. 下列说法正确的是( )A、只用水就可以鉴别四氯化碳、苯和乙醇 B、C2H4、C3H6、C6H6分子中,所有原子处于同一平面上 C、光照条件下,氯气与乙烷发生化学反应,生成的产物有6种 D、有机物
D、CHCl3
6. 下列说法正确的是( )A、只用水就可以鉴别四氯化碳、苯和乙醇 B、C2H4、C3H6、C6H6分子中,所有原子处于同一平面上 C、光照条件下,氯气与乙烷发生化学反应,生成的产物有6种 D、有机物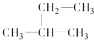 与氯气发生取代反应,生成的一氯代物有5种
7. 烷烃
与氯气发生取代反应,生成的一氯代物有5种
7. 烷烃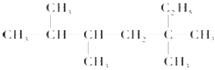 是单烯烃R和H2发生加成反应后的产物,则R可能的结构有( ) A、4种 B、7种 C、6种 D、5种8. 用NA表示阿伏加德罗常数.下列说法正确的是( )A、标准状况下,22.4L苯中含有的苯分子数是NA B、标准状况下,1mol氦气中含有的核外电子数为4NA C、常温常压下,15g乙烷分子中含有的碳氢键数目为3NA D、常温常压下,0.10mol•L﹣1 CH3COOH溶液中含有的H+数小于0.1NA9. 下列叙述正确的是( )
是单烯烃R和H2发生加成反应后的产物,则R可能的结构有( ) A、4种 B、7种 C、6种 D、5种8. 用NA表示阿伏加德罗常数.下列说法正确的是( )A、标准状况下,22.4L苯中含有的苯分子数是NA B、标准状况下,1mol氦气中含有的核外电子数为4NA C、常温常压下,15g乙烷分子中含有的碳氢键数目为3NA D、常温常压下,0.10mol•L﹣1 CH3COOH溶液中含有的H+数小于0.1NA9. 下列叙述正确的是( )①在盛有硝酸银的烧杯中放入用导线连接的铜片和银片,正极质量不变.
②相邻的同系物分子组成上相差一个CH2原子团
③丙烯分子中三个碳原子在同一平面上,其一氯代物只有2种
④由ⅠA族和ⅥA族短周期元素形成的原子个数比为1:1,电子总数为38的化合物,是含有共价键的离子型化合物
⑤等物质的量乙烷与氯气在光照条件下反应,可用这个方法制取一氯乙烷.
A、①③ B、②⑤ C、①⑤ D、②④10. 已知在苯分子中,不存在单、双键交替的结构.下列可以作为证据的实验事实是( )①苯不能使酸性KMnO4溶液褪色
②苯中6个碳碳键完全相同
③苯的一溴代物没有同分异构体
④实验室测得邻二甲苯只有一种结构
⑤苯不能使溴水因反应而褪色.
A、②③④⑤ B、①③④⑤ C、①②③④ D、①②④⑤11. 已知断裂1molC﹣H键,要吸收热量414.4kJ;断裂1mol C﹣C键,要吸收热量347.4kJ;生成1mol C═C键,会放出热量615.3kJ;生成1mol H﹣H键,会放出热量435.3kJ,某有机物分解的反应可表示为: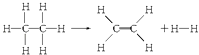
若在反应中消耗了1mol乙烷(反应物),则有关该反应的说法正确的是( )
A、该反应放出251.2 kJ的热量 B、该反应吸收251.2 kJ的热量 C、该反应放出125.6 kJ的热量 D、该反应吸收125.6 kJ的热量12. 某鱼雷采用Al﹣Ag2O动力电池,以溶解有氢氧化钾的流动海水为电解液,电池反应为:2Al+3Ag2O+2KOH═6Ag+2KAlO2+H2O,下列说法不正确的是( )A、Ag2O为电池的正极 B、Al在电池反应中被氧化 C、电子由Ag2O极经外电路流向Al极 D、溶液中的OH﹣向Al极迁移13. 元素周期表的形式多种多样,图是扇形元素周期表的一部分,对比中学常见元素周期表,分析其元素的填充规律,判断下列说法正确的是( )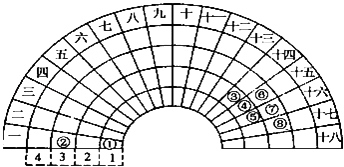 A、③元素形成的单质晶体均属于原子晶体 B、②、⑦、⑧对应的简单离子半径依次减小 C、②⑤形成的化合物阴阳离子个数比可能为1:1 D、④元素的气态氢化物易液化,是因为其分子间存在氢键14. 有四种短周期元素(除稀有气体之外)X,Y,M,N,其中X是短周期中金属性最强的元素;Y原子的最外层电子数是最内层电子数的3倍,是电子层数的2倍;M的单质是一种有色气体,可用于自来水的消毒;N的最高价氧化物对应的水化物是药物胃舒平的有效成分,该药物用于治疗胃酸过多.下列说法正确的是( )A、X有两种常见氧化物,所含的化学键类型完全相同 B、N与M形成的化合物的水溶液显酸性 C、离子半径:N>X,Y>M D、气态氢化物的稳定性:Y>M15. 有关下列物质分子结构特征描述正确的是( )A、乙烯容易与溴的四氯化碳溶液发生反应,且1mol乙烯完全加成消耗1mol溴单质,证明乙烯分子里含有一个碳碳双键 B、苯分子的结构中存在碳碳单键和碳碳双键交替出现的结构 C、
A、③元素形成的单质晶体均属于原子晶体 B、②、⑦、⑧对应的简单离子半径依次减小 C、②⑤形成的化合物阴阳离子个数比可能为1:1 D、④元素的气态氢化物易液化,是因为其分子间存在氢键14. 有四种短周期元素(除稀有气体之外)X,Y,M,N,其中X是短周期中金属性最强的元素;Y原子的最外层电子数是最内层电子数的3倍,是电子层数的2倍;M的单质是一种有色气体,可用于自来水的消毒;N的最高价氧化物对应的水化物是药物胃舒平的有效成分,该药物用于治疗胃酸过多.下列说法正确的是( )A、X有两种常见氧化物,所含的化学键类型完全相同 B、N与M形成的化合物的水溶液显酸性 C、离子半径:N>X,Y>M D、气态氢化物的稳定性:Y>M15. 有关下列物质分子结构特征描述正确的是( )A、乙烯容易与溴的四氯化碳溶液发生反应,且1mol乙烯完全加成消耗1mol溴单质,证明乙烯分子里含有一个碳碳双键 B、苯分子的结构中存在碳碳单键和碳碳双键交替出现的结构 C、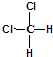 和
和 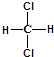 属于同一种物质,不能用来解释甲烷是一种正四面体结构
D、1mol CH3CH2OH与Na完全反应只生成0.5mol H2 , 不能说明乙醇分子中有一个氢原子与其它氢原子不同
16. 干电池原理示意图如图,电池总反应为:Zn+2NH4+═Zn2++2NH3↑+H2↑,下列说法正确的是( )
属于同一种物质,不能用来解释甲烷是一种正四面体结构
D、1mol CH3CH2OH与Na完全反应只生成0.5mol H2 , 不能说明乙醇分子中有一个氢原子与其它氢原子不同
16. 干电池原理示意图如图,电池总反应为:Zn+2NH4+═Zn2++2NH3↑+H2↑,下列说法正确的是( )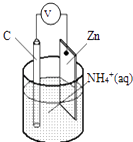 A、碳为电池的负极 B、Zn极上发生氧化反应 C、电流由锌极流向碳极 D、H2在Zn片上生成17. 香叶醇结构简式如图,下列有关香叶醇的叙述正确的是( )
A、碳为电池的负极 B、Zn极上发生氧化反应 C、电流由锌极流向碳极 D、H2在Zn片上生成17. 香叶醇结构简式如图,下列有关香叶醇的叙述正确的是( )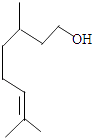 A、香叶醇的分子式为C10H20O B、不能使溴的四氯化碳溶液褪色 C、不能使酸性高锰酸钾溶液褪色 D、能发生加成反应,不能发生取代反应18. 标准状况下两种等物质的量的可燃气体共1.68L,其中一种是烃,在足量氧气中完全燃烧.若将产物通入足量澄清石灰水,得到的白色沉淀质量为15.0g;若用足量碱石灰吸收燃烧产物,增重9.3g.则这两种混合气体可能为( )A、H2与C2H4 B、CO与C2H4 C、H2与C4H6 D、CO 与C3H619. 短周期主族元素A;B;C;D、E的原子序数依次递增,A;B两元素相邻,B;C、E原子的最外层电子数之和为13,E原子最外层电子数是B原子内层电子数的3倍或者C原子最外层电子数的3倍,B;D原子最外层电子数之和等于C;E原子最外层电子数之和.下列说法正确的是( )
A、香叶醇的分子式为C10H20O B、不能使溴的四氯化碳溶液褪色 C、不能使酸性高锰酸钾溶液褪色 D、能发生加成反应,不能发生取代反应18. 标准状况下两种等物质的量的可燃气体共1.68L,其中一种是烃,在足量氧气中完全燃烧.若将产物通入足量澄清石灰水,得到的白色沉淀质量为15.0g;若用足量碱石灰吸收燃烧产物,增重9.3g.则这两种混合气体可能为( )A、H2与C2H4 B、CO与C2H4 C、H2与C4H6 D、CO 与C3H619. 短周期主族元素A;B;C;D、E的原子序数依次递增,A;B两元素相邻,B;C、E原子的最外层电子数之和为13,E原子最外层电子数是B原子内层电子数的3倍或者C原子最外层电子数的3倍,B;D原子最外层电子数之和等于C;E原子最外层电子数之和.下列说法正确的是( )
A、元素A所形成的氧化物只有一种 B、元素B的最高价氧化物对应的水化物为强酸 C、元素C,D,E的最高价氧化物对应的水化物两两之间可发生反应 D、氢化物的稳定性:A>B20. 原子序数依次增大的元素a、b、c、d,它们的最外层电子数分别为1、6、7、1.a﹣的电子层结构与氦相同,b和c的次外层有8个电子,c﹣和d+的电子层结构相同.下列叙述错误的是( )A、元素的非金属性次序为c>b>a B、a和其他3种元素均能形成共价化合物 C、d和其他3种元素均能形成离子化合物 D、元素a、b、c各自最高和最低化合价的代数和分别为0、4、6二、填空题
-
21. 如图所示,某气体X可能由H2、CO、CH4中的一种或几种组成.将X气体燃烧,把燃烧后生成的气体通过A、B两个洗气瓶.试回答下列问题:
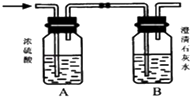 (1)、若A洗气瓶的质量增加,B洗气瓶的质量不变,则气体X是 .(2)、若A洗气瓶的质量不变,B洗气瓶的质量增加,则气体X是 .(3)、若A、B两个洗气瓶的质量都增加,则气体X可能是(可以不填满)
(1)、若A洗气瓶的质量增加,B洗气瓶的质量不变,则气体X是 .(2)、若A洗气瓶的质量不变,B洗气瓶的质量增加,则气体X是 .(3)、若A、B两个洗气瓶的质量都增加,则气体X可能是(可以不填满)①
②
③
④
⑤
22. ① H与 H;②O2与O3;③正丁烷(CH3CH2 CH2 CH3)与异丁烷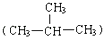 ;④甲烷(CH4)与丙烷(C3H8). (1)、互为同位素的是(填序号,下同).(2)、互为同系物的是 .(3)、互为同分异构体的是 .(4)、互为同素异形体的是 .23. A~E等几种烃分子的球棍模型如图所示,据此回答下列问题.
;④甲烷(CH4)与丙烷(C3H8). (1)、互为同位素的是(填序号,下同).(2)、互为同系物的是 .(3)、互为同分异构体的是 .(4)、互为同素异形体的是 .23. A~E等几种烃分子的球棍模型如图所示,据此回答下列问题.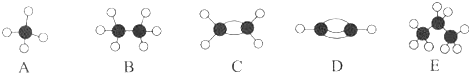 (1)、D的化学式为 , A的二氯取代物有种.(2)、可作为植物生长调节剂的是(填序号).24. 乙烯的产量可以用来衡量一个国家的石油化工发展水平.请回答:(1)、若将乙烯气体通入溴的四氯化碳溶液中,反应的化学方程式为: .(2)、可以用来除去乙烷中混有的乙烯的试剂是 . (填序号)
(1)、D的化学式为 , A的二氯取代物有种.(2)、可作为植物生长调节剂的是(填序号).24. 乙烯的产量可以用来衡量一个国家的石油化工发展水平.请回答:(1)、若将乙烯气体通入溴的四氯化碳溶液中,反应的化学方程式为: .(2)、可以用来除去乙烷中混有的乙烯的试剂是 . (填序号)①水 ②氢气 ③溴的四氯化碳溶液 ④酸性高锰酸钾溶液
(3)、在一定条件下,乙烯能与水反应生成有机物A.A的结构简式是 , 其反应类型是反应(填“取代”或“加成”).(4)、下列化学反应原理相同的是(填序号)①乙烯使溴的四氯化碳溶液和酸性高锰酸钾溶液褪色;
②SO2使溴水和酸性高锰酸钾溶液褪色;
③SO2使品红溶液和滴有酚酞的NaOH溶液褪色.
25. 由A、B、C、D四种金属按表中装置进行实验.装置
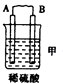
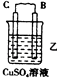
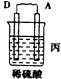
现象
二价金属A不断溶解
C的质量增加
A上有气体产生
根据实验现象回答下列问题:
①装置乙中正极的电极反应式是
②四种金属活动性由强到弱的顺序是 .
26. 由Zn一Cu一硫酸溶液组成的原电池,工作一段时间后锌片的质量减少了6.5g.回答下列问题:溶液中的H+移向(填“正极”或“负极’).负极的电极反应式是 , 标准状况下生成 L气体.27. 断开1mol H一H键、1mol N一H键、1mol N≡N 键分别需要吸收能量为436kJ、391kJ、946kJ,求:H2与N2反应生成0.5molNH3填 (“吸收”或“放出”)能量 kJ.28. 原子序数大于4的主族元素A和B的离子分别为Am+和Bn﹣ , 已知它们的核外电子排布相同,据此推断:①A和B所属周期数之差为(填具体数字) .
②A和B的核电荷数之差为(用含m或n的式子表示)
③B和A的族序数之差为 .
29. A,B,C,D均是短周期元素,A和B同周期,B和C同族,A元素族序数是周期数的三倍,B原子最外层电子数是内层电子数的二倍,B与A能生成化合物BA2 , C与A生成化合物CA2 , A的阴离子与D的阳离子电子层结构相同,都与氖原子的电子层结构相同,D 的单质与A 的单质在不同条件下反应,可生成D2A或D2A2 . 请回答(1)、写出元素符号B: C:(2)、BA2的电子式 , BA2分子中化学键属于键..(3)、D2A2的化学式 , 灼烧这化合物火焰呈色.(4)、C在元素周期表中的位置是第周期,族,其原子结构示意图 .30. 人们应用原电池原理制作了多种电池以满足不同的需要.电池发挥着越来越重要的作用,如在宇宙飞船、人造卫星、电脑、照相机等,都离不开各式各样的电池,同时废弃的电池随便丢弃也会对环境造成污染.请根据题中提供的信息,回答下列问题: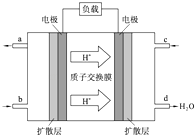 (1)、研究人员最近发明了一种“水”电池,这种电池能利用淡水与海水之间含盐量的差别进行发电,在海水中电池反应可表示为:5MnO2+2Ag+2NaCl═Na2Mn5O10+2AgCl
(1)、研究人员最近发明了一种“水”电池,这种电池能利用淡水与海水之间含盐量的差别进行发电,在海水中电池反应可表示为:5MnO2+2Ag+2NaCl═Na2Mn5O10+2AgCl①该电池的负极反应式是;
②在电池中,Na+不断移动到“水”电池的极(填“正”或“负”);
③外电路每通过4mol电子时,生成Na2Mn5O10的物质的量是 .
(2)、中国科学院应用化学研究所在甲醇(CH3OH是一种可燃物)燃料电池技术方面获得新突破.甲醇燃料电池的工作原理如图所示.①该电池工作时,b口通入的物质为 .
②该电池负极的电极反应式 .
③工作一段时间后,当6.4g甲醇完全反应生成CO2时,有 NA个电子转移.
(3)、Ag2O2是银锌碱性电池的正极活性物质,当银锌碱性电池的电解质溶液为KOH溶液,电池放电时正极的Ag2O2转化为Ag,负极的Zn转化为K2Zn(OH)4 , 写出该电池反应方程式: .三、计算题