仁爱湘教版初中化学九年级下学期专题八 单元3:金属的锈蚀和防护
试卷更新日期:2018-04-09 类型:单元试卷
一、单选题
-
1. “珍惜资源、爱护环境”是每位公民应尽的义务,下列相关做法错误的是( )A、我国稀土金属储量世界第一,可以任意开发利用 B、研发秸秆综合利用技术,避免因直接焚烧而造成大气污染 C、利用二氧化碳捕捉技术,减少因二氧化碳引起的“温室效应” D、改造城市排水管网,实现雨水和生活污水的分流处理与利用2. 铁钉在钉入木制品时,有经验的木匠习惯用口水将铁钉润湿,你认为这样做的主要目的是( )
A、使铁钉更容易钉入木制品 B、这是为了使铁钉更易生锈,防止脱落 C、这是为了防止铁钉生锈而腐蚀 D、增大钉入时的摩擦力3. 如图是探究铁锈蚀条件的装置。调节L端与R端的液面高度一致,塞紧木塞,一周后观察。
下列推断错误的是( )
A、b管中铁钉不会锈蚀 B、L端与R端液面高度仍然保持一致 C、该实验说明铁锈蚀与空气、水有关 D、a管中水面处铁钉锈蚀最明显4. 铁在潮湿的空气里会发生锈蚀,证明氧气一定参加了反应必须要做的实验是( ) A、①② B、①③ C、②③ D、①②③5. 小刚用pH试纸测得家庭常用洗涤剂的pH如下表所示:
A、①② B、①③ C、②③ D、①②③5. 小刚用pH试纸测得家庭常用洗涤剂的pH如下表所示:物质
厕所清洁剂
洗发精
洗衣液
厨房清洁剂
pH
1
8
10
13
在没有除锈剂的情况下,可以用来替代除锈剂的是( )
A、厕所清洁剂 B、洗发精 C、洗衣液 D、厨房清洁剂6. 铁是生产和生活中使用最多的金属材料,下列关于铁的叙述不正确的是( )
A、铁生锈时生成四氧化三铁 B、表面涂漆以防止铁生锈 C、铁制品应放置于干燥的环境中 D、经常清扫铁器表面灰尘可以防止铁生锈二、填空题
-
7. 铁制品锈蚀的过程,实际上是铁与空气中的和等发生化学反应的过程。据有关资料报导,世界上每年因腐蚀而报废的金属设备或材料相当于年产量的20%~40%。保护金属资源,人人有责。请写出一条防止铁制品生锈的方法。铁锈的主要成分是 , 通常可用除去铁表面的铁锈,写出有关反应的化学方程式:。8.
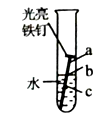
如图所示,铁钉最容易生锈的是处(填“a”、“b”或“c”),常用稀硫酸除去铁锈,写出该反应的化学方程式: .

三、实验探究题
-
9. 铜、铁是人类使用最早、应用广泛的金属.
 (1)、(一)对古代制品的认识
(1)、(一)对古代制品的认识青铜铸件、丝绸织品、陶瓷器皿是我国古代劳动人民创造的辉煌成就.
①上述制品不涉及到的材料是(选填序号).
A、金属材料 B、无机非金属材料 C、复合材料
②如图1为出土文物古代青铜铸件“马踏飞燕”.该文物能保存至今的原因可能是(选填序号).
A、铜的活泼性弱 B、铜不会生锈 C、深埋于地下,隔绝空气
(2)、(二)铁、铜的冶炼①我国古代曾用孔雀石炼铜,涉及主要反应的化学方程式: , 2CuO+C 2Cu+CO2↑.
②铁、铜矿石有赤铁矿(Fe2O3)、磁铁矿(Fe3O4)、黄铁矿(FeS2)、黄铜矿(CuFeS2)等.CuFeS2为二硫化亚铁铜,其中S元素的化合价为 .
③工业炼铁大多采用赤铁矿、磁铁矿.以磁铁矿为原料炼铁反应的化学方程式为 . 炼铁不采用黄铁矿、黄铜矿,可能的原因是:黄铁矿、黄铜矿含铁量相对低; .
④以黄铜矿为原料,采用生物炼铜是现代炼铜的新工艺,原理为:4CuFeS2+17O2+2H2SO4 4CuSO4+2Fe2(SO4)3+2H2O.
向上述反应后的溶液中加入Fe粉,得到FeSO4溶液和Cu.
1)发生主要反应的化学方程式:Fe+Fe2(SO4)3=3FeSO4 , .
2)FeSO4溶液经蒸发浓缩、、过滤等操作得到FeSO4•7H2O晶体.
(3)、(三)黄铜矿中铁、铜含量的测定在科研人员指导下,兴趣小组称取25.00g黄铜矿(含少量Fe2O3和其它不含金属元素的杂质)模拟生物炼铜,使其全部转化为CuSO4、Fe2(SO4)3溶液.向溶液中加入过量NaOH溶液得到Cu(OH)2、Fe(OH)3固体.
①证明NaOH溶液过量的方法:静置,向上层清液中滴加溶液,无现象.
②用图2装置对固体进行热分解实验.
【资料】
①在68℃时,Cu(OH)2分解为CuO;在500℃时,Fe(OH)3分解为Fe2O3 .
②在1400℃时,CuO分解为Cu2O和O2 , Fe2O3分解为复杂的铁的氧化物和O2 .
1)装配好实验装置后,先要 .
2)停止加热后仍需继续通N2 , 可防止倒吸和 .
3)控制不同的温度对A中固体加热,测得装置B和C中铜网的质量变化如表.
温度/℃
室温
100
550
1400
B装置/g
200.00
201.80
205.04
205.04
C中铜网/g
100.00
100.00
100.00
101.28
①此黄铜矿中铜、铁元素的质量分数:ω(Cu)%=;ω(Fe)%= .
②复杂的铁的氧化物化学式为 .
四、综合题
-
10. 钢铁是重要的金属材料,在生产、生活中有广泛的用途。建造北京奥运会主体育场“鸟巢”,就是用了大量的钢铁。(1)、钢铁属于(填“纯净物”或“混合物”);(2)、每年世界上钢铁的产量很高,钢铁的锈蚀也给人类带来了巨大的损失。铁在空气中锈蚀,实际上是铁跟空气中的和共同作用的结果;
(3)、为了防止钢铁锈蚀,人们常采用在其表面涂刷矿物油或镀上其他金属等覆盖保护膜的方法。这些方法都能防止锈蚀的共同原理是;
(4)、炼铁厂常以焦炭、赤铁矿(主要成分是氧化铁)、空气等为主要原料炼铁,反应过程如下:
请写出第③步反应的化学方程式:;
(5)、金属矿物的储量有限,而且不能再生;目前世界上已有50%以上的废钢铁得到回收利用,其目的是(填“合理开采矿物”或“节约金属资源”)。
-