仁爱湘教版初中化学九年级下学期专题八 单元2:金属的性质
试卷更新日期:2018-04-09 类型:同步测试
一、单选题
-
1. 用数轴表示某些化学知识直观、简明、易记,下列表达正确的是( )A、少 多 B、弱 强 C、小 大 D、小 大2. 如图,在杠杆的两端分别挂着质量相等的铜球和锌球,这时杠杆平衡。然后将两球分别浸没在稀硫酸和CuSO4溶液中片刻,下列说法中正确的是( )
 A、只有左边烧杯中溶液的质量增加 B、只有右边烧杯中溶液的质量增加 C、两边烧杯中溶液的质量都增加 D、去掉烧杯后,杠杆仍然保持平衡3. 不能由金属与酸反应直接生成的是( )A、FeCl2 B、ZnCl2 C、FeCl3 D、MgSO44. 下列说法符合图中漫画情景的是( )
A、只有左边烧杯中溶液的质量增加 B、只有右边烧杯中溶液的质量增加 C、两边烧杯中溶液的质量都增加 D、去掉烧杯后,杠杆仍然保持平衡3. 不能由金属与酸反应直接生成的是( )A、FeCl2 B、ZnCl2 C、FeCl3 D、MgSO44. 下列说法符合图中漫画情景的是( )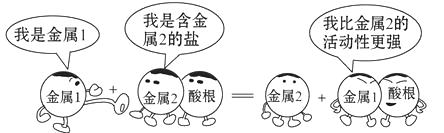 A、此反应可能是复分解反应 B、若金属1是锌,金属2可能是银 C、此反应可能是Cu+2AgCl=2Ag+CuCl2 D、比较铁和铜的活动性强弱可以用硫酸镁溶液5. 有X、Y、Z三种金属,其中Y能与稀硫酸反应产生氢气,而X、Z不能与稀硫酸反应;将Z浸入X的盐溶液中,Z的表面有X析出,则X、Y、Z的金属活动性由强到弱的顺序是( )A、X、Y、Z B、Y、Z、X C、Y、X、Z D、Z、X、Y6. 向含有AgNO3、Cu(NO3)2的混合溶液中加入一定量的铁粉,充分反应后过滤,向滤出的固体中滴加稀硫酸,有气体生成,则滤出的固体一定为( )
A、此反应可能是复分解反应 B、若金属1是锌,金属2可能是银 C、此反应可能是Cu+2AgCl=2Ag+CuCl2 D、比较铁和铜的活动性强弱可以用硫酸镁溶液5. 有X、Y、Z三种金属,其中Y能与稀硫酸反应产生氢气,而X、Z不能与稀硫酸反应;将Z浸入X的盐溶液中,Z的表面有X析出,则X、Y、Z的金属活动性由强到弱的顺序是( )A、X、Y、Z B、Y、Z、X C、Y、X、Z D、Z、X、Y6. 向含有AgNO3、Cu(NO3)2的混合溶液中加入一定量的铁粉,充分反应后过滤,向滤出的固体中滴加稀硫酸,有气体生成,则滤出的固体一定为( )
A、Ag、Cu两种单质的混合物 B、Cu、Fe两种单质的混合物 C、Ag、Fe两种单质的混合物 D、Ag、Cu、 Fe三种单质的混合物7. 等质量的稀硫酸分别与足量的镁、铁、锌三种金属反应,下列图像能正确反映生成氢气质量与反应时间之间关系的是( )
A、 B、
B、 C、
C、 D、
D、 8. 如图所示的四个图象,能正确反映对应变化关系的是( )A、
8. 如图所示的四个图象,能正确反映对应变化关系的是( )A、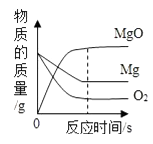 镁在氧气中燃烧
B、
镁在氧气中燃烧
B、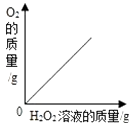 向二氧化锰中加入过氧化氢溶液
C、
向二氧化锰中加入过氧化氢溶液
C、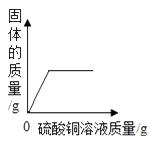 向一定量铁粉和铜粉的混合物中加入硫酸铜溶液
D、
向一定量铁粉和铜粉的混合物中加入硫酸铜溶液
D、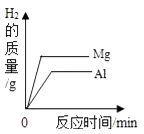 等质量的镁、铝分别与质量分数相等且足量的稀硫酸反应
9. 将a g铁粉加到bgZnSO4和 CuSO4的混合溶液中,充分反应后过滤,得到滤液和滤渣.下列有关说法中,不合理的是( )A、滤渣的质量一定大于a g,滤液的质量一定小于bg B、若滤渣中含有Fe,则滤液一定呈浅绿色 C、向滤渣中加入足量稀盐酸,滤渣全部溶解 D、若滤渣中只含有单质Cu,则滤液中至少含有两种金属阳离子10. 某些化学小组设计了验证Fe、Cu、Ag的金属活动性顺序的四种方案,各个方案选用的试剂如下,其中不可行的是( )A、Fe、CuSO4溶液、Ag B、FeCl2溶液、Cu、AgNO3溶液 C、Ag、CuSO4溶液、FeSO4溶液 D、Fe、Cu、AgNO3溶液、盐酸
等质量的镁、铝分别与质量分数相等且足量的稀硫酸反应
9. 将a g铁粉加到bgZnSO4和 CuSO4的混合溶液中,充分反应后过滤,得到滤液和滤渣.下列有关说法中,不合理的是( )A、滤渣的质量一定大于a g,滤液的质量一定小于bg B、若滤渣中含有Fe,则滤液一定呈浅绿色 C、向滤渣中加入足量稀盐酸,滤渣全部溶解 D、若滤渣中只含有单质Cu,则滤液中至少含有两种金属阳离子10. 某些化学小组设计了验证Fe、Cu、Ag的金属活动性顺序的四种方案,各个方案选用的试剂如下,其中不可行的是( )A、Fe、CuSO4溶液、Ag B、FeCl2溶液、Cu、AgNO3溶液 C、Ag、CuSO4溶液、FeSO4溶液 D、Fe、Cu、AgNO3溶液、盐酸二、填空题
-
11. 在做金属化学性质探究实验时:
①已知金属A和B能够发生如下反应:Zn+ACl2=ZnCl2+A B+ZnCl2=BCl2+Zn判断Zn、A、B三种 金属的活动性由强到弱依次是 .
②某同学不小心把实验后的铁钉和铜丝倒入含有稀硫酸的废液缸中,发现有气泡产生,用化学方程式解释产生气泡的原因 .
12. 向硝酸银、硝酸铜、硝酸亚铁的混合溶液中加入一定质量的锌粉,反应停止后过滤,得滤渣A和滤液B.向滤渣A中加入稀盐酸,有气泡冒出.则滤渣A中一定有;滤液B中一定有的金属离子是 , 一定没有的金属离子是 .三、实验探究题
-
13. 下图为某学习小组探究金属化学性质时所做的四个实验,仔细分析后回答下列问题:
 (1)、描述A中的实验现象。(2)、写出C中反应的化学方程式。(3)、要证明Cu、Fe、Ag的活动性顺序,至少要做的实验是(填序号)。(4)、开始反应后D中溶液逐渐变为黄色,原因是。
(1)、描述A中的实验现象。(2)、写出C中反应的化学方程式。(3)、要证明Cu、Fe、Ag的活动性顺序,至少要做的实验是(填序号)。(4)、开始反应后D中溶液逐渐变为黄色,原因是。四、综合题
-
14. 现有铜与另一种金属R(可能是银、镁、铁中的一种)的混合粉末。欲确定R的成分,请你一起完成:
(1)、请将银、镁、铁三种金属的元素符号填写在下列金属活动性顺序表中的相应位置。 (2)、取少量的金属粉末于试管中,逐滴加入稀硫酸,有气泡产生,则R不可能是。(3)、待不再产生气泡时,再进行(填写一种实验操作方法),得到溶液和铜。然后往溶液中加入洁净的锌片,锌片表面有金属析出,则R是。(4)、写出金属R与稀硫酸反应的化学方程式。该反应的基本类型属于(填“化合”“分解”“置换”或“复分解”)反应。
(2)、取少量的金属粉末于试管中,逐滴加入稀硫酸,有气泡产生,则R不可能是。(3)、待不再产生气泡时,再进行(填写一种实验操作方法),得到溶液和铜。然后往溶液中加入洁净的锌片,锌片表面有金属析出,则R是。(4)、写出金属R与稀硫酸反应的化学方程式。该反应的基本类型属于(填“化合”“分解”“置换”或“复分解”)反应。五、计算题
-
15. 黄铜是铜、锌合金,它可用来制造机器、电器零件及日用品。为测定某黄铜样品中铜的质量分数,现取10 g该样品粉碎,加入到50 g稀硫酸中,恰好完全反应,测得剩余固体质量为3.5 g。计算:(1)、黄铜样品中铜的质量分数。(2)、稀硫酸中溶质的质量分数。(3)、由此得到启示是:在使用黄铜制品时应注意。(合理即可)
-
-