2016-2017学年河南省河南大学荆紫关附中 高二上学期开学化学试卷
试卷更新日期:2016-11-30 类型:开学考试
一、选择题
-
1. 下列有关材料的说法不正确的是( )A、制造普通水泥和玻璃的主要原料都用到石灰石 B、工业上制玻璃不会有温室气体的排放 C、玻璃钢是将玻璃纤维和高分子材料复合而成的复合材料 D、“中国”的英文单词叫China,这是由于中国制造的某种物质驰名世界,这种物质是陶瓷2. 下列物质跟盐酸不能发生反应的是( )A、碱式碳酸铜 B、硫酸氢钠 C、碳酸钠 D、双羟基铝碳酸钠3. 下列各组离子中,一定能大量共存的是( )A、加入铝粉只有氢气产生的溶液中:Na+、SO42﹣、NO3﹣、Mg2+、 B、滴加石蕊试液显红色的溶液中:Fe3+、NH4+、Cl﹣、SCN﹣ C、在0.1mol/L的NaHSO4溶液中:NH4+、Na+、Al3+、Cu2+、NO3﹣ D、在0.1mol/L的NaHCO3溶液中K+、Al3+、Fe3+、NO3﹣4. 下列哪一种粒子的发现,首次动摇了当时流行的“原子不可分”的传统化学观( )A、电子 B、原子核 C、质子 D、中子5. 海洋中有丰富的食品、矿产、能源、药物和水产资源,下图为海水利用的部分过程.

下列有关说法正确的是( )
A、制取NaHCO3的反应是利用其溶解度小于NaCl B、用澄清的石灰水可鉴别NaHCO3和Na2CO3 C、在工段③、④、⑤中,溴元素均被氧化 D、工业上通过电解饱和MgCl2溶液制取金属镁6. 随着科学技术的不断进步,研究物质的手段和途径越来越多,N5+、H3、O4、C60等已被发现.下列有关说法中,正确的是( )A、N5+离子中含有36个电子 B、O2与O4属于同位素 C、C60是有机物 D、H2与H3属于同种元素组成的单质7. 一定温度下,向容积为2L的密闭容器通入两种气体后发生化学反应,反应中各物质的物质的量变化如图所示,对该反应的推断合理的是( ) A、该反应的化学方程式为3B+4D═6A+2C B、反应进行到6s时v(B)=v(C) C、反应进行到6s时,用B表示的平均反应速率为0.05mol•L﹣1•s﹣1 D、反应进行到6s时,反应停止了8. 下列有关工业生产的叙述不正确的是( )A、用海水淡化后的浓缩海水作原料提取溴 B、在太阳能资源相对充足的沿海地区建造海水淡化厂 C、利用“海水→氯化钠→金属钠→氢氧化钠”的工艺流程生产烧碱 D、利用“海水→氢氧化镁→氯化镁→金属镁”的工艺流程生产金属镁9. 下列有关物质检验的实验结论正确的是( )
A、该反应的化学方程式为3B+4D═6A+2C B、反应进行到6s时v(B)=v(C) C、反应进行到6s时,用B表示的平均反应速率为0.05mol•L﹣1•s﹣1 D、反应进行到6s时,反应停止了8. 下列有关工业生产的叙述不正确的是( )A、用海水淡化后的浓缩海水作原料提取溴 B、在太阳能资源相对充足的沿海地区建造海水淡化厂 C、利用“海水→氯化钠→金属钠→氢氧化钠”的工艺流程生产烧碱 D、利用“海水→氢氧化镁→氯化镁→金属镁”的工艺流程生产金属镁9. 下列有关物质检验的实验结论正确的是( )选项
实 验 操 作 及 现 象
实 验 结 论
A
向某溶液中加入盐酸酸化的氯化钡溶液,有白色沉淀生成
该溶液中一定含有SO
B
向某溶液中加入盐酸,能产生使澄清石灰水变浑浊的气体
该溶液中一定含CO32﹣
C
向某溶液中加入适量NaOH稀溶液,将湿润的红色石蕊试纸放在试管口,试纸不变色
该溶液中一定不含NH4+
D
用干燥洁净的铂丝蘸取某溶液放在酒精灯火焰上灼烧,透过蓝色钴玻璃观察到火焰呈紫色
该溶液一定含有钾元素,可能含有钠元素
A、A B、B C、C D、D10. 下列关于金属性质的叙述中正确的是( )A、钠与氧气反应时,产物是由O2的用量决定的 B、铝箔在空气中受热可以熔化且会发生剧烈燃烧 C、金属与非金属发生反应时,被氧化的一定是金属 D、铁丝不论在空气中还是纯氧中都不会燃烧11. 下列说法正确的是( )A、1molH2的体积为22.4L B、阿伏加德罗常数为6.02×1023 C、摩尔质量等于该粒子的相对原子质量或相对分子质量 D、Na+的摩尔质量为23g/mol12. 下列离子方程式中,正确的是( )A、碳酸氢钠在水中的电离:NaHCO3═Na++H++CO32﹣ B、钠与水的反应:2Na+2H2O═2Na++2OH﹣+H2↑ C、氯气和水的反应:Cl2+H2O═2H++Cl﹣+ClO﹣ D、铝和烧碱溶液的反应:Al+2OH﹣═AlO﹣2+H2↑13. 下列各组溶液,只用胶头滴管和试管,不用其它任何试剂就可以鉴别的是( )①Al2(SO4)3和KOH ②稀盐酸和稀Na2CO3
③NaAlO2和H2SO4 ④Ba(OH)2和NaHCO3 .
A、① B、①③ C、①②③ D、①②③④14.下列有关图示分析正确的是( )
 A、如图a所示,集气瓶内充满Cl2和CH4的混合气体或NO2和O2的混合气体,置于光亮处,将滴管内的水挤入集气瓶后,烧杯中的水会进入集气瓶,并可能充满集气瓶 B、如图b所示,X为铁棒,Y为铜棒,a为直流电源,当S闭合后,当b为NaOH溶液,X极附近产生白色沉淀时,电子从X极流入a C、Pt为电极,电解含0.10 mol M+和0.1 mol N3+(M+、N3+均为金属阳离子)的溶液,阴极析出金属单质或气体的总物质的量(y)与导线中通过电子的物质的量(x)的关系如图c,离子氧化能力M+>N3+>H+ D、图d为N2(g)和O2(g)生成NO(g)过程中的能量变化,则N≡N的键能为946kJ/mol,热化学方程式为:N2(g)+O2(g)=2NO(g)△H=﹣180 kJ/mol15. 某固体混合物可能由Al、(NH4)2SO4、MgCl2、FeCl2、AlCl3中的两种或多种组成,现对该混合物做如下实验,所得现象和有关数据如图所示(气体体积数据已换算成标准状况下的体积):关于该固体混合物,下列说法正确的是( )
A、如图a所示,集气瓶内充满Cl2和CH4的混合气体或NO2和O2的混合气体,置于光亮处,将滴管内的水挤入集气瓶后,烧杯中的水会进入集气瓶,并可能充满集气瓶 B、如图b所示,X为铁棒,Y为铜棒,a为直流电源,当S闭合后,当b为NaOH溶液,X极附近产生白色沉淀时,电子从X极流入a C、Pt为电极,电解含0.10 mol M+和0.1 mol N3+(M+、N3+均为金属阳离子)的溶液,阴极析出金属单质或气体的总物质的量(y)与导线中通过电子的物质的量(x)的关系如图c,离子氧化能力M+>N3+>H+ D、图d为N2(g)和O2(g)生成NO(g)过程中的能量变化,则N≡N的键能为946kJ/mol,热化学方程式为:N2(g)+O2(g)=2NO(g)△H=﹣180 kJ/mol15. 某固体混合物可能由Al、(NH4)2SO4、MgCl2、FeCl2、AlCl3中的两种或多种组成,现对该混合物做如下实验,所得现象和有关数据如图所示(气体体积数据已换算成标准状况下的体积):关于该固体混合物,下列说法正确的是( ) A、一定含有Al,其质量为4.5g B、一定不含FeCl2 , 可能含有MgCl2和AlCl3 C、一定含有MgCl2和FeCl2 D、一定含有(NH4)2SO4和MgCl2 , 且物质的量相等
A、一定含有Al,其质量为4.5g B、一定不含FeCl2 , 可能含有MgCl2和AlCl3 C、一定含有MgCl2和FeCl2 D、一定含有(NH4)2SO4和MgCl2 , 且物质的量相等二、解答题
-
16. 称取一定质量的纯碱,溶于水后与盐酸完全反应放出CO2 , 用“增多”或“减少”填空.(1)、若纯碱中含NaHCO3所需盐酸用量 , 产生的气体;(2)、若纯碱中含K2CO3所需盐酸用量 , 产生的气体;(3)、若纯碱中含NaCl所需盐酸用量 , 产生的气体 .17. 现向含6mol KI的硫酸溶液中逐滴加入KBrO3溶液,整个过程中含碘物质的物质的量与所加入KBrO3的物质的量的关系如图1所示.已知

①BrO3﹣+6I一+6H+=3I2+Br﹣+3H2O;
②2BrO3﹣+I2=2IO3﹣+Br2;
请回答下列问题:
(1)、b点时,KI反应完全,则消耗的氧化剂与还原剂物质的量之比为 , 还原产物是 .(2)、b→c过程中只有一种元素的化合价发生变化,写出该过程的离子反应方程式 .(3)、由反应②有同学由此得出氧化性:I2>Br2的结论,你认为是否正确,并说明理由 .(4)、含6mol KI的硫酸溶液所能消耗n(KBrO3)的最大值为 .(5)、加碘食盐中含有碘酸钾(KIO3),现以电解法制备碘酸钾,实验装置如图2所示.先将一定量的碘溶于过量氢氧化钾溶液,发生反应:3I2+6KOH=5KI+KIO3+3H2O,将该溶液加入阳极区,另将氢氧化钾溶液加入阴极区,开始电解.阳极的电极反应式为;阴极观察到的现象是 .18. A,B,C,D,E为原子序数依次增大的短周期元素,已知A,B,E 3种原子最外层共有11个电子,且这3种元素的最高价氧化物的水化物两两皆能发生反应生成盐和水,C元素的最外层电子数比次外层电子数少4,D元素原子次外层电子数比最外层电子数多3.(1)、写出下列元素符号:ABCD(2)、写出A,B两元素最高价氧化物的水化物相互反应的化学方程式 .19. 某兴趣小组探究SO2气体还原Fe3+、I2 , 他们使用的药品和装置如下图所示: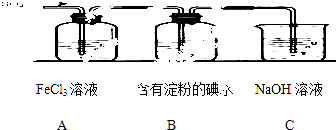 (1)、装置C的作用是 .(2)、若要从FeSO4溶液获得FeSO4•7H2O晶体,必须进行的实验操作步骤:、、过滤、洗涤、自然干燥.(3)、根据以上现象,该小组同学认为SO2 与 FeCl3溶液发生氧化还原反应.
(1)、装置C的作用是 .(2)、若要从FeSO4溶液获得FeSO4•7H2O晶体,必须进行的实验操作步骤:、、过滤、洗涤、自然干燥.(3)、根据以上现象,该小组同学认为SO2 与 FeCl3溶液发生氧化还原反应.①写出SO2与FeCl3溶液反应的离子方程式;
②请写出检验A烧杯中有Fe2+生成的操作方法;
③该小组同学向C烧杯反应后的溶液中加入硝酸酸化的BaCl2溶液,若出现白色沉淀,即可证明反应生成了SO42﹣ . 该做法(填“合理”或“不合理”),理由是 .
(4)、能表明I﹣的还原性弱于SO2的现象是 .20. 某同学按下列步骤配制100mL0.200mol•L﹣1Na2CO3溶液,请回答有关问题.实验步骤
有关问题
(1)计算所需Na2CO3的质量
需要Na2CO3的质量为 .
(2)称量Na2CO3固体
称量过程中应用到的主要仪器是 .
(3)将Na2CO3加入100mL烧杯中,加入适量蒸馏水
为了加快溶解速率,常采取的措施是 .
(4)将烧杯中的溶液转移至仪器A(已检查不漏水)中
①在转移Na2CO3溶液前应将溶液 ;
②仪器A是 ;
③为防止溶液溅出,应采取的措施是 .
(5)向仪器A中加蒸馏水至刻度线
在进行此操作时应注意的问题是 .
(6)摇匀、装瓶,操作B,最后清洁、整理
操作B是 .
讨论按上述步骤配制的Na2CO3溶液的浓度 (选填“是”或“不是”)0.200mol•L﹣1 . 理由是 .
21. 11.2g铁粉与足量稀盐酸恰好完全反应.请计算.(1)、生成氢气的物质的量;(2)、这些氢气在标准状况下的体积.22. 了解用药常识,有利于自我保健.现有下列药物:A、麻黄碱 B、抗酸药(氢氧化铝) C、青霉素 D、阿司匹林(乙酰水杨酸)
(1)、治疗胃酸过多,但患有严重的胃溃疡,应该选择 .(2)、可治疗支气管哮喘,但不宜过多服用的药物是 .(3)、一种重要的抗生素类药,有阻止多种细菌生长的功能,该药物是 .(4)、能使发热的病人体温降至正常,并起到缓解疼痛的作用,该药物是 .23. 物质A~K有如下的转化关系,其中D、E为气体单质,试回答(图中有些反应的产物和反应的条件没有全部标出): (1)、写出下列物质的化学式:D是 , G是;(2)、写出“C→F”反应的离子方程式;(3)、写出反应“F→G”的离子方程式;(4)、写出反应“I→J”的离子方程式;(5)、在溶液I中滴入NaOH溶液,可观察到的现象是;写出相关的化学反应方程式 .(6)、向200mL 3mol/L溶液J中加入60g铁、铜混合物(铁和铜的物质的量比为1:1),充分反应后过滤,向滤液中通入足量的氨气,充分反应后再过滤、洗涤、干燥、灼烧,灼烧后得到固体的质量为 .24. X,Y,D,E,F…都是中学化学中的常见物质,已知Y是单质,X是化合物,溶液E中滴入KSCN溶液呈血红色.这些物质间的相互关系如框图所示,根据框图及提示的信息回答下列问题:
(1)、写出下列物质的化学式:D是 , G是;(2)、写出“C→F”反应的离子方程式;(3)、写出反应“F→G”的离子方程式;(4)、写出反应“I→J”的离子方程式;(5)、在溶液I中滴入NaOH溶液,可观察到的现象是;写出相关的化学反应方程式 .(6)、向200mL 3mol/L溶液J中加入60g铁、铜混合物(铁和铜的物质的量比为1:1),充分反应后过滤,向滤液中通入足量的氨气,充分反应后再过滤、洗涤、干燥、灼烧,灼烧后得到固体的质量为 .24. X,Y,D,E,F…都是中学化学中的常见物质,已知Y是单质,X是化合物,溶液E中滴入KSCN溶液呈血红色.这些物质间的相互关系如框图所示,根据框图及提示的信息回答下列问题: (1)、Y和X的浓溶液反应的条件是 , 若无该条件,反应将很难进行,其原因是 .(2)、写出F﹣→G+X的离子方程式: .(3)、L转化为I的化学方程式是 .(4)、在试管中制备L,为了能观察到L的颜色,需要进行特殊的操作,该特殊的操作是 .(5)、将Cu放入0.1mol•L﹣1 Fe(NO3)3溶液中,反应一段时间后取出Cu片,溶液中c(Fe3+):c(Fe2+)=2:3,则Cu2+与Fe3+的物质的量之比为 .
(1)、Y和X的浓溶液反应的条件是 , 若无该条件,反应将很难进行,其原因是 .(2)、写出F﹣→G+X的离子方程式: .(3)、L转化为I的化学方程式是 .(4)、在试管中制备L,为了能观察到L的颜色,需要进行特殊的操作,该特殊的操作是 .(5)、将Cu放入0.1mol•L﹣1 Fe(NO3)3溶液中,反应一段时间后取出Cu片,溶液中c(Fe3+):c(Fe2+)=2:3,则Cu2+与Fe3+的物质的量之比为 .