浙教版科学八年级下学期第二章(1--2节)提升训练
试卷更新日期:2018-04-04 类型:同步测试
一、单选题
-
1. 图中所示的标志中,加油站必须张贴的是( )A、
 B、
B、 C、
C、 D、
D、 2. 下列标志中,属于物品回收标志的是( )A、
2. 下列标志中,属于物品回收标志的是( )A、 B、
B、 C、
C、 D、
D、 3. 不同的事物可用不同的符号来表示,下列关于符号特点的说法,不确切的是( )
3. 不同的事物可用不同的符号来表示,下列关于符号特点的说法,不确切的是( )
A、简明性 B、完整性 C、统一性 D、方便性4. 在科学探究的过程中,会用到很多科学方法,如控制变量法、放大法、分类法、模型法等,下列用到模型法的是( )A、根据生物能否进行光合作用分为植物和动物 B、用光线表示光的传播方向 C、探究压力的作用效果与哪些因素有关 D、将一用细线悬挂着的乒乓球轻轻靠在发声的音叉上,乒乓球会被弹开,这一现象说明发声的音叉在振动5. 有一密封容器内储存有一定量的氧气,上面有一个不漏气的活塞,慢慢下压活塞,密封容器内部分子变化模型合理的是( )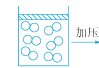 A、
A、 B、
B、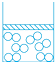 C、
C、 D、
D、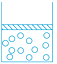 6. 下列表达方式中不属于模型的是( )A、水分子
6. 下列表达方式中不属于模型的是( )A、水分子 B、电压表
B、电压表  C、漏斗
C、漏斗  D、磁感线
D、磁感线  7. “超临界水”(水分子中含有一个氧原子和两个氢原子)因具有许多优良特性而被科学家追捧,它是指当温度和压强达到一定值时,水的液态和气态完全交融在一起的状态,用“小空心圆”表示氢原子,“
7. “超临界水”(水分子中含有一个氧原子和两个氢原子)因具有许多优良特性而被科学家追捧,它是指当温度和压强达到一定值时,水的液态和气态完全交融在一起的状态,用“小空心圆”表示氢原子,“ ”表示氧原子,下列模型中,能表示“超临界水”分子的是( )
”表示氧原子,下列模型中,能表示“超临界水”分子的是( )
A、 B、
B、 C、
C、 D、
D、 8. 物质的构成与原子和分子的关系正确的是( )A、分子 物质 原子 B、分子 原子 物质 C、原子 物质 分子 D、原子 分子 物质9. 固态碘受热后变成了紫红色的碘蒸气,无论是固态碘还是碘蒸气都能使切开的土豆变成蓝色,这说明( )A、分子在不停地运动 B、分子间有一定的间隔 C、分子有一定的大小 D、同种分子化学性质相同10. 若用“空心圆”表示碳原子,用“实心圆”表示氧原子,则保持二氧化碳的化学性质的粒子可表示为( )
8. 物质的构成与原子和分子的关系正确的是( )A、分子 物质 原子 B、分子 原子 物质 C、原子 物质 分子 D、原子 分子 物质9. 固态碘受热后变成了紫红色的碘蒸气,无论是固态碘还是碘蒸气都能使切开的土豆变成蓝色,这说明( )A、分子在不停地运动 B、分子间有一定的间隔 C、分子有一定的大小 D、同种分子化学性质相同10. 若用“空心圆”表示碳原子,用“实心圆”表示氧原子,则保持二氧化碳的化学性质的粒子可表示为( )
A、 B、
B、 C、
C、 D、
D、 11. 下列关于分子和原子的说法,错误的是( )A、分子和原子都可以构成物质 B、由分子构成的物质,分子是保持其化学性质的最小粒子 C、在化学变化中,分子可以分成原子,原子又可以结合成新的分子 D、分子和原子之间都有间隔,分子之间间隔较大,原子之间间隔较小12. 下列各图是气体微粒的示意图,图中“空心圆”和“实心圆”分别表示两种不同的原子,那么其中表示同种分子的是( )
11. 下列关于分子和原子的说法,错误的是( )A、分子和原子都可以构成物质 B、由分子构成的物质,分子是保持其化学性质的最小粒子 C、在化学变化中,分子可以分成原子,原子又可以结合成新的分子 D、分子和原子之间都有间隔,分子之间间隔较大,原子之间间隔较小12. 下列各图是气体微粒的示意图,图中“空心圆”和“实心圆”分别表示两种不同的原子,那么其中表示同种分子的是( )
A、 B、
B、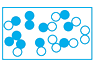 C、
C、 D、
D、 13. “一滴水中约有1.67×1021个水分子”说明了( )
13. “一滴水中约有1.67×1021个水分子”说明了( )
A、分子很小 B、分子可以再分 C、分子之间有间隔 D、分子在不断地运动14. 微粒构成物质,千差万别的物质形成了丰富多彩的物质世界,下列关于微粒的叙述,不正确的是( )
A、微粒有大小 B、微粒有质量 C、微粒间有间隔 D、微粒不运动15. 分子是构成物质的一种粒子,下列有关分子的叙述中,错误的是( )
A、受热时分子的体积逐渐变大 B、降温时分子的运动速率减慢 C、液体蒸发变成气体,分子间间隔变大 D、电解水生成氢气和氧气,说明分子是可分的16. 氧气在一定条件下变成淡蓝色液体,此过程中发生变化的是( )
A、氧分子的体积 B、氧分子的间隔 C、氧气的化学性质 D、构成氧分子的原子17.20世纪初,科学家先后提出了如图①、②、③所示的三种原子模型,依照提出时间的先后顺序正确的排列是( )
 A、①②③ B、③②① C、②③① D、①③②18. 原子核中一定含有的粒子是( )A、中子 B、质子 C、电子 D、质子和中子19. 已知碳-14原子中,原子核内含有6个质子和8个中子,则碳-14原子核外电子数为( )
A、①②③ B、③②① C、②③① D、①③②18. 原子核中一定含有的粒子是( )A、中子 B、质子 C、电子 D、质子和中子19. 已知碳-14原子中,原子核内含有6个质子和8个中子,则碳-14原子核外电子数为( )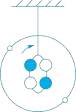 A、6 B、8 C、12 D、1420. 如图所示为小明制作的原子模型,外圈上的小球为电子,内圈为原子核,下列说法正确的是( )
A、6 B、8 C、12 D、1420. 如图所示为小明制作的原子模型,外圈上的小球为电子,内圈为原子核,下列说法正确的是( )
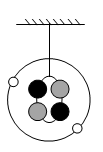 A、该模型表示一种碳原子 B、该原子的核电荷数为4 C、该原子的质量主要集中在2个电子上 D、该原子核由2个质子和2个中子构成21. 同一原子中,下列说法错误的是( )A、质子和电子的数目相同 B、原子和中子的电性不同 C、原子核和电子的质量不同 D、原子核和原子的体积不同22. 图甲是卢瑟福用α粒子轰击原子而产生散射的实验,在分析实验结果的基础上,他提出了图乙所示的原子核式结构,卢瑟福的这一研究过程是一个( )
A、该模型表示一种碳原子 B、该原子的核电荷数为4 C、该原子的质量主要集中在2个电子上 D、该原子核由2个质子和2个中子构成21. 同一原子中,下列说法错误的是( )A、质子和电子的数目相同 B、原子和中子的电性不同 C、原子核和电子的质量不同 D、原子核和原子的体积不同22. 图甲是卢瑟福用α粒子轰击原子而产生散射的实验,在分析实验结果的基础上,他提出了图乙所示的原子核式结构,卢瑟福的这一研究过程是一个( ) A、建立模型的过程 B、得出结论的过程 C、提出问题的过程 D、验证证据的过程23. 2004年诺贝尔物理学奖颁给了美国的三位科学家——格罗斯、波利泽和维尔泽克,他们在有关原子核内夸克之间存在的强作用力的研究方面作出了重要的贡献。下列有关夸克的说法不正确的是( )A、夸克是目前原子核中发现的最小粒子 B、质子和中子都由夸克构成 C、不是所有分子中都存在夸克粒子 D、夸克是科学研究的一个热点24. 如图所示为某原子的结构示意图,该原子的原子核中可能有( )
A、建立模型的过程 B、得出结论的过程 C、提出问题的过程 D、验证证据的过程23. 2004年诺贝尔物理学奖颁给了美国的三位科学家——格罗斯、波利泽和维尔泽克,他们在有关原子核内夸克之间存在的强作用力的研究方面作出了重要的贡献。下列有关夸克的说法不正确的是( )A、夸克是目前原子核中发现的最小粒子 B、质子和中子都由夸克构成 C、不是所有分子中都存在夸克粒子 D、夸克是科学研究的一个热点24. 如图所示为某原子的结构示意图,该原子的原子核中可能有( ) A、6个质子和8个中子 B、4个质子和5个中子 C、6个质子和8个电子 D、8个质子和6个电子25. 汤姆生和卢瑟福都对现代原子结构理论做出了巨大贡献。下列关于原子结构的论述中,不属于他们两人共同观点的是( )A、原子很小,但可以分 B、原子是电中性的 C、原子中的电子带负电荷 D、原子由原子核和核外电子构成26. 美国夏威夷联合天文中心的科学家发现了一种新型氢粒子,它由三个氕原子核和两个电子构成。这对解释宇宙演化提供了新的参考。对于这种粒子,下列说法中错误的是( )A、它一定含有3个中子 B、它比一个普通氢分子多一个氢原子核 C、它的组成可以用H3+表示 D、它的化学性质与H2不同27. 某粒子核内所含的核电荷数为17,核外电子数为18,该粒子一定是( )
A、6个质子和8个中子 B、4个质子和5个中子 C、6个质子和8个电子 D、8个质子和6个电子25. 汤姆生和卢瑟福都对现代原子结构理论做出了巨大贡献。下列关于原子结构的论述中,不属于他们两人共同观点的是( )A、原子很小,但可以分 B、原子是电中性的 C、原子中的电子带负电荷 D、原子由原子核和核外电子构成26. 美国夏威夷联合天文中心的科学家发现了一种新型氢粒子,它由三个氕原子核和两个电子构成。这对解释宇宙演化提供了新的参考。对于这种粒子,下列说法中错误的是( )A、它一定含有3个中子 B、它比一个普通氢分子多一个氢原子核 C、它的组成可以用H3+表示 D、它的化学性质与H2不同27. 某粒子核内所含的核电荷数为17,核外电子数为18,该粒子一定是( )
A、原子 B、分子 C、阴离子 D、阳离子28. 下列关于镁原子、镁离子两种粒子的判断中,不正确的是( )
A、核电荷数相同 B、质量几乎相等 C、镁离子比镁原子稳定 D、电子数与质子数相同29. 已知R元素的相对原子质量m与其原子核内的质子数和中子数之和在数值上相等。若R2+核外有x个电子,则其原子核内的中子数为( )A、m-x+2 B、m+x-2 C、m-x-2 D、m+x+230. 下列对分子、原子、离子的认识,不正确的是( )A、分子、原子、离子都能构成物质 B、气体压缩为液体,分子体积变小 C、温度越高,分子运动越快 D、钠原子和钠离子的化学性质不同31. 生物体死亡后,体内含有的碳14会逐渐减少(称为衰变),因此科学家可通过测量生物体遗骸中碳14的含量,来计算它存活的年代,这种方法称为放射性碳测年法。碳14原子核中含6个质子与8个中子,在衰变时,一个中子变成质子,形成新的原子核。下列关于新原子核的说法正确的是( )A、碳原子核,含7个质子,8个中子 B、氮原子核,含7个质子,7个中子 C、碳原子核,含6个质子,7个中子 D、氧原子核,含7个质子,8个中子32. 氚是氢的一种同位素,氚原子含有1个质子和2个中子。下列示意图能正确表示氚原子结构的是( ) A、
A、 B、
B、 C、
C、 D、
D、 33. 碳-12、碳-13、碳-14都是碳的同位素原子,它们的主要差别在于( )A、电子数目不同 B、中子数目不同 C、质子数目不同 D、化学性质不同34. 科学上常用元素符号左下角数字表示原子的质子数,左上角数字表示原子的中子数与质子数之和,如 613C表示核内有6个质子和7个中子的碳原子。下列关于 53131I和 53127I的说法中错误的是( )
33. 碳-12、碳-13、碳-14都是碳的同位素原子,它们的主要差别在于( )A、电子数目不同 B、中子数目不同 C、质子数目不同 D、化学性质不同34. 科学上常用元素符号左下角数字表示原子的质子数,左上角数字表示原子的中子数与质子数之和,如 613C表示核内有6个质子和7个中子的碳原子。下列关于 53131I和 53127I的说法中错误的是( )
A、各取一个原子相比较,中子数相同 B、属于同种元素 C、各取一个原子相比较,核外电子数相同 D、各取一个原子相比较,质子数相同35. 用“ ”“
”“  ”和“实心圆”分别表示质子、中子和电子,如图表示四种原子结构模型,下列有关说法正确的是( )
”和“实心圆”分别表示质子、中子和电子,如图表示四种原子结构模型,下列有关说法正确的是( ) A、甲、丁互为同位素 B、乙、丁为同一种元素 C、甲、丙的核电荷数不同 D、甲、丙为同一种原子36. 不同种元素最本质的区别是( )
A、甲、丁互为同位素 B、乙、丁为同一种元素 C、甲、丙的核电荷数不同 D、甲、丙为同一种原子36. 不同种元素最本质的区别是( )
A、中子数不同 B、质子数不同 C、原子质量不同 D、核外电子数不同二、填空题
-
37. 二氧化碳是一种与我们生活密切相关的物质。但我们却无法用肉眼直接看到构成二氧化碳气体的分子,因而人们就用二氧化碳的分子模型来表示二氧化碳的结构。如图所示是二氧化碳的分子模型,其中每一个单元表示一个二氧化碳分子,每个单元中的黑色小球表示碳原子,白色小球表示氧原子。
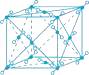 (1)、根据图中的结构模型,你能看出一集气瓶的二氧化碳气体其实是由许许多多个构成。而每个二氧化碳分子都是由构成的。(2)、如果用大写字母“C”表示碳原子,用“O”表示氧原子,原子的个数表示在字母的右下角。请你写出用字母表示的二氧化碳的符号:。38. 阅读有关科学发展的材料,回答相关的问题。
(1)、根据图中的结构模型,你能看出一集气瓶的二氧化碳气体其实是由许许多多个构成。而每个二氧化碳分子都是由构成的。(2)、如果用大写字母“C”表示碳原子,用“O”表示氧原子,原子的个数表示在字母的右下角。请你写出用字母表示的二氧化碳的符号:。38. 阅读有关科学发展的材料,回答相关的问题。原子结构认识史:
“实心球模型”(道尔顿)→“西瓜模型”(汤姆生)→“核式结构模型”(卢瑟福)→“分层模型”(玻尔)→……
科学家对原子内部结构的研究仍在继续。但也有科学家质疑:原子内部的微粒真的无限可分吗?
(1)、科学家在探索原子结构内部奥秘时,在不断的实验中重建模型,下列有关模型的说法,合理的是 。A、模型是在实验和发现中不断修正和完善的 B、模型一定是研究对象本身的放大或缩小,不可改变 C、建立模型有助于我们认识和理解许多自然事物的本质(2)、根据以上信息,谈谈你对科学发展的认识: (写出一点即可)。39. 如图所示是电解水的过程中水分子分解的示意图。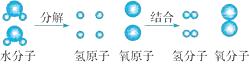 (1)、从微观粒子角度而言,水通电时,水分子分裂成和 , 分裂出来的又重新组合成 , 它们不再有水的化学性质。可见,是保持水的化学性质的最小微粒。
(1)、从微观粒子角度而言,水通电时,水分子分裂成和 , 分裂出来的又重新组合成 , 它们不再有水的化学性质。可见,是保持水的化学性质的最小微粒。
(2)、由该实验可知,分子由构成,是化学变化中的最小粒子。分子和原子的本质区别是。
40. 用“ ”和“
”和“  ”分别表示氮原子和氧原子,如图所示是氮气与氧气在放电条件下发生反应的微观模拟图。请回答下列问题:
”分别表示氮原子和氧原子,如图所示是氮气与氧气在放电条件下发生反应的微观模拟图。请回答下列问题: (1)、在B图中将相关粒子图形补充完整。(2)、此过程中发生变化的粒子是。(3)、结合该图,从微观角度解释由A到B变化的实质是。41. 如图所示为氧化汞受热分解的示意图(图中大圆圈表示汞原子,小圆圈表示氧原子)。
(1)、在B图中将相关粒子图形补充完整。(2)、此过程中发生变化的粒子是。(3)、结合该图,从微观角度解释由A到B变化的实质是。41. 如图所示为氧化汞受热分解的示意图(图中大圆圈表示汞原子,小圆圈表示氧原子)。
根据图示你得出的结论有:①从物质构成角度看,;②从物质变化角度看,。(各写出一条即可)
42.读图回答下列问题:
 (1)、过氧化氢分子中有种原子;甲醛分子中有种原子;1个甲烷分子中有个原子;1个甲醛分子中有个原子;1个水分子中有个原子。(2)、比较氢分子(或氧分子)与水分子,可得出什么结论?。(3)、比较过氧化氢和水分子、乙炔分子和甲烷分子,可得出什么结论?。43. 如图所示是用来说明原子内部结构的示意图。由图可知:原子由和构成,原子核由和中子构成。
(1)、过氧化氢分子中有种原子;甲醛分子中有种原子;1个甲烷分子中有个原子;1个甲醛分子中有个原子;1个水分子中有个原子。(2)、比较氢分子(或氧分子)与水分子,可得出什么结论?。(3)、比较过氧化氢和水分子、乙炔分子和甲烷分子,可得出什么结论?。43. 如图所示是用来说明原子内部结构的示意图。由图可知:原子由和构成,原子核由和中子构成。 44. 人类对原子结构的认识,经历了汤姆生、卢瑟福和玻尔等提出的模型的过程。(1)、卢瑟福核式结构模型是在α粒子轰击金箔实验的基础上提出的。下列能正确反映他的实验结果的示意图是 (填序号)。
44. 人类对原子结构的认识,经历了汤姆生、卢瑟福和玻尔等提出的模型的过程。(1)、卢瑟福核式结构模型是在α粒子轰击金箔实验的基础上提出的。下列能正确反映他的实验结果的示意图是 (填序号)。 (2)、从原子结构模型建立的过程中,我们发现 (填字母)。A、科学模型的建立是一个不断完善、不断修正的过程 B、模型在科学研究中起着很重要的作用 C、玻尔的原子模型的建立,使人们对原子结构的认识达到了完美的境界 D、人类借助模型的建立,对原子的认识逐渐接近本质45. 分子、原子、离子都是构成物质的粒子,下列物质由分子直接构成的是 , 由原子直接构成的是 , 由离子直接构成的是。
(2)、从原子结构模型建立的过程中,我们发现 (填字母)。A、科学模型的建立是一个不断完善、不断修正的过程 B、模型在科学研究中起着很重要的作用 C、玻尔的原子模型的建立,使人们对原子结构的认识达到了完美的境界 D、人类借助模型的建立,对原子的认识逐渐接近本质45. 分子、原子、离子都是构成物质的粒子,下列物质由分子直接构成的是 , 由原子直接构成的是 , 由离子直接构成的是。①氧气 ②镁 ③氯化钠 ④二氧化碳
46. 请填表并比较氯原子与氯离子、镁原子与镁离子、镁离子与氯离子,把它们的异同点写在横线上。粒子名称
核内质子数
核外电子数
粒子所带电荷
镁原子
12
12
0
镁离子
12
10
两个单位正电荷
氯原子
17
17
0
氯离子
17
18
一个单位负电荷
氯原子与氯离子:。
镁原子与镁离子:。
镁离子与氯离子:。
47. 在分子、原子、质子、中子、电子、原子核、阳离子、阴离子这些微粒中:
(1)、显电中性的微粒有。
(2)、带正电的微粒有。
(3)、带负电的微粒有。
(4)、质量最小的微粒是。
(5)、化学变化中,一定发生变化的微粒有。
(6)、在同一原子里数目相等的是。

