四川省雅安市2017-2018学年高二上学期化学期末考试试卷
试卷更新日期:2018-04-03 类型:期末考试
一、单选题
-
1. 2014年中科院大连化物所包信和团队研究甲烷高效转化获重大突破。催化原理如图所示,该研究彻底摒弃了高耗能的合成气制备过程,大大缩短了工艺路线,反应过程本身实现了二氧化碳的零排放,碳原子利用效率达到100%。关于该反应的下列说法错误的是( )
 A、催化剂降低了反应的活化能 B、CH4→CH3+H的过程需要吸收能量 C、该反应符合绿色化学原理 D、CH3 是稳定结构2. 区别晶体与非晶体的最科学的方法是( )A、观察各向异性 B、X射线衔射实验 C、测定固定熔点 D、观察自范性3. 原子结构模型经历了五个主要阶段:1803年实心球模型→1897年葡萄干面包式模型→1911年原子核式结构模型→1913 的轨道模型→20 世纪初电子云的原子结构模型。对轨道模型贡献最大的科学家是( )
A、催化剂降低了反应的活化能 B、CH4→CH3+H的过程需要吸收能量 C、该反应符合绿色化学原理 D、CH3 是稳定结构2. 区别晶体与非晶体的最科学的方法是( )A、观察各向异性 B、X射线衔射实验 C、测定固定熔点 D、观察自范性3. 原子结构模型经历了五个主要阶段:1803年实心球模型→1897年葡萄干面包式模型→1911年原子核式结构模型→1913 的轨道模型→20 世纪初电子云的原子结构模型。对轨道模型贡献最大的科学家是( )
A、玻尔 B、汤姆生 C、卢瑟福 D、道尔顿4. 下列物质中,既含有离子键,又含有非极性共价键的是( )A、Na2O2 B、CaCl2 C、NH4Cl D、H2O5. 用电负性数据不能判断的是( )A、某元素是金属还是非金属 B、氢化物HY和HX键的极性强弱 C、化学键是离子键还是共价健 D、化合物溶解度6. 下列氯元素含氧酸酸性最弱的是( )A、HClO4 B、HClO3 C、HClO2 D、HClO7. 下列分子属极性分子的是( )A、C2H4 B、CO2 C、NH3 D、BCl38. 某化学反应的反应物浓度在20 s内由3.0 mol/L变为1.0 mol/L,则以该反应物浓度的变化表示20s内的平均反应速率为( )A、0.05 mol/(L·s) B、0.10 mol/(L·s) C、0.15 mol/(L·s) D、2.0 mol/(L·s)9. 已知NH3·H2O (aq) 与H2SO4 (aq) 反应生成1mol 正盐的反应热△H=-24.2kJ/moL;稀盐酸与稀氢氧化钠溶液反应的中和热△H=-57.3kJ/mol。则NH3·H2O在水溶液中电离的△H等于( )A、+45.2 kJ/mol B、-45.2 kJ/mol C、+69.4kJ/mol D、-69.4kJ/mol10. 下列现象不能用“相似相溶”解释的是( )A、氯化氢易溶于水 B、用CCl4 萃取碘水中的碘 C、氯气易溶于NaOH溶液 D、苯与水混合静置后分层11. 已知短周期元素形成的离子aW3+、bX+、cY2﹣、dZ﹣都具有相同的电子层结构,下列关系正确的是( )A、离子的还原性Y2﹣<Z﹣ B、离子半径X+>W3+ C、质子数c>b D、氢化物的稳定性H2Y>HZ12. 根据价层电子对互斥模型,判断下列分子或者离子的空间构型不是三角锥形的是( )A、PCl3 B、H3O+ C、NO3- D、PH3+13. 对于反应H2(g)+I2(g) 2HI(g),能量变化如图所示,下列说法错误的是( ) A、该反应是放热反应 B、升高温度平衡向逆反应方向移动 C、增大压强,平衡不发生移动 D、升高温度,反应的平衡常数K增大14. 我国成功实现持续开采可燃冰。可燃冰是天然气和水在海底300m-3000m的深度形成的固体,可表示为mCH4·nH2O。下列哪个条件不是形成可燃冰必须具备的( )A、低压 B、低温 C、高压 D、充足的CH4来源15. 在通常条件下,下列各组物质的性质排列正确的是( )A、Na、Mg、Al的第一电离能逐渐增大 B、热稳定性:HF>H2O>NH3 C、S2﹣、Cl﹣、K+的半径逐渐增大 D、O、F、Ne的电负性逐渐增大16. 若某原子在处于能量最低状态时,价电子层排布为4d25s2 , 则下列说法正确的是( )A、该元素原子最外层共有4个电子 B、该元素原子核外第N层上共有10个不同运动状态的电子 C、该元素处于第五周期IVA族 D、该元素原子第四电子层上有4个空轨道17. 25℃和1.01×105Pa时,反应2N2O5(g)=4NO2(g)+O2(g) △H=+56.7kJ/mol,自发进行的原因是( )A、是吸热反应 B、是放热反应 C、是熵减少的反应 D、熵增大效应大于能量效应18. 根据下表给出的几种物质的熔点、沸点数据,判断下列有关说法中错误的是( )
A、该反应是放热反应 B、升高温度平衡向逆反应方向移动 C、增大压强,平衡不发生移动 D、升高温度,反应的平衡常数K增大14. 我国成功实现持续开采可燃冰。可燃冰是天然气和水在海底300m-3000m的深度形成的固体,可表示为mCH4·nH2O。下列哪个条件不是形成可燃冰必须具备的( )A、低压 B、低温 C、高压 D、充足的CH4来源15. 在通常条件下,下列各组物质的性质排列正确的是( )A、Na、Mg、Al的第一电离能逐渐增大 B、热稳定性:HF>H2O>NH3 C、S2﹣、Cl﹣、K+的半径逐渐增大 D、O、F、Ne的电负性逐渐增大16. 若某原子在处于能量最低状态时,价电子层排布为4d25s2 , 则下列说法正确的是( )A、该元素原子最外层共有4个电子 B、该元素原子核外第N层上共有10个不同运动状态的电子 C、该元素处于第五周期IVA族 D、该元素原子第四电子层上有4个空轨道17. 25℃和1.01×105Pa时,反应2N2O5(g)=4NO2(g)+O2(g) △H=+56.7kJ/mol,自发进行的原因是( )A、是吸热反应 B、是放热反应 C、是熵减少的反应 D、熵增大效应大于能量效应18. 根据下表给出的几种物质的熔点、沸点数据,判断下列有关说法中错误的是( )晶体
NaCl
KCl
AlCl3
SiCl4
单质B
熔点/℃
810
776
190
-68
2300
沸点/℃
1465
1418
180
57
2500
A、AlCl3加热能升华 B、单质B 可能是原子晶体 C、NaCl中化学键的强度比KCl 中的小 D、SiCl4是分子晶体19. 1mol H2燃烧生成液态水时放出285.8kJ 热量,下列表示该反应的热化学方程式正确的是( )A、2H2(g)+O2(g)=2H2O(l) △H =-142.9kJ/mol B、2H2(g)+O2(g)=2H2O(l) △H =+571.6 kJ/mol C、2H2(g)+O2(g)=2H2O(l) △H =-57l.6 kJ/mol D、2H2+O2=2H2O △H =-571.6kJ/mol20. 氰气的分子式为(CN)2 , 结构式为N C-C N,性质与卤素相似,下列叙述正确的是( )A、分子中四原子共直线,是非极性分子 B、N C 键的键长大于C C键的键长 C、分子中含有2个σ键和4个π键 D、氰气不和氢氧化钠溶液发生反应二、填空题
-
21. 反应A(g)+B(g) C(g)+D(g)过程中的能量变化如图所示,回答下列问题。
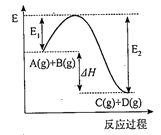 (1)、该反应是反应(填“吸热”或“放热”)。(2)、△H=。(3)、反应体系中加入催化剂对反应热是否有影响?(填“有影响”“无影响”)。(4)、升高温度,该反应的平衡常数K 将(填“增大”“减小”或“不变”)。22. 元素X 位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2。元素Y基态原子的3p 轨道上有4个电子。元素Z 的原子最外层电子数是其内层的3倍。
(1)、该反应是反应(填“吸热”或“放热”)。(2)、△H=。(3)、反应体系中加入催化剂对反应热是否有影响?(填“有影响”“无影响”)。(4)、升高温度,该反应的平衡常数K 将(填“增大”“减小”或“不变”)。22. 元素X 位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2。元素Y基态原子的3p 轨道上有4个电子。元素Z 的原子最外层电子数是其内层的3倍。 (1)、X与Y所形成化合物晶体的晶胞如右图所示。
(1)、X与Y所形成化合物晶体的晶胞如右图所示。①在1个晶胞中,X离子的数目为。
②该化合物的化学式为。
(2)、在Y的氢化物(H2Y)分子中,Y原子轨道的杂化类型是。(3)、Z的氢化物(H2Z)在乙醇中的溶解度大于H2Y,其原因是。(4)、Y 与Z 可形成YZ42-①YZ42-的空间构型为。
②写出一种与YZ42-互为等电子体的分子的化学式:。
(5)、X的氯化物与氨水反应可形成配合物[X(NH3)4]Cl2 , 1mol该配合物中含有σ键的数目为。23. 二甲醚(CH3OCH3)被称为21世纪的新型燃料,以CO和H2为原料生产二甲醚主要发生以下三个反应:化学反应方程式
化学平衡常数
①CO(g)+2H2(g) CH3OH(g)
ΔH1=-99 kJ•mol-1
K1
②2CH3OH(g) CH3OCH3(g)+H2O(g)
ΔH2=-24 kJ•mol-1
K2
③CO(g)+H2O(g) CO2(g)+H2(g)
ΔH3=-41 kJ•mol-1
K3
(1)、该工艺的总反应为3CO(g)+3H2(g) CH3OCH3(g)+CO2(g) ΔH该反应ΔH= , 化学平衡常数K=(用含K1、K2、K3的代数式表示)。
(2)、某温度下,将8.0molH2和4.0molCO充入容积为2L的密闭容器中,发生反应:4H2(g)+2CO(g) CH3OCH3(g)+H2O(g),10 分钟后反应达平衡,测得二甲醚的体积分数为25%,则CO的转化率为。(3)、下列措施中,能提高CH3OCH3产率的有________。A、分离出二甲醚 B、升高温度 C、改用高效催化剂 D、增大压强(4)、该工艺中反应③的发生提高了CH3OCH3的产率,原因是。三、实验题
-
24. 某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响,在室温下按照如下方案完成实验。
实验编号
反应物
催化剂
①
10mL2% H2O2溶液
无
②
10mL5% H2O2溶液
无
③
10mL5% H2O2溶液
1mL0.1mol/LlFeCl3溶液
④
10mL5% H2O2溶液+少量HCl溶液
1mL0.1mol/LlFeCl3溶液
⑤
10mL5% H2O2溶液+少量NaOH溶液
1mL0.1mol/LlFeCl3溶液
(1)、催化剂能加快化学反应速率的原因是。(2)、实验①和②的目的是。实验时由于较长时间没有观察到明显现象而无法得出结论。资料显示,通常条件下H2O2稳定,不易分解。为了达到实验目的,你对原实验方案的改进。(3)、写出实验③的化学反应方程式。(4)、实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如图。分析上图能够得出的实验结论是。
四、综合题
-
25. Cu3N具有良好的电学和光学性能,在电子工业领城、航空航天领域、国防领域、通讯领域以及光学工业等领域中,发挥着广泛的、不可替代的作用。(1)、Cu+的核外电子排布式为;N元素与O元素的第一电离能比较:NO(填“>”、“<”或“=”)。(2)、与N3-含有相同电子数的四原子分子的空间构型为。(3)、在Cu催化作用下,乙醇可被空气氧化为乙醛(CH3CHO),乙醛分子中醛其(
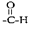 )碳原子的杂化方式为。 (4)、[Cu(H2O)4]2+为平面正方形结构,其中的两个H2O被Cl-取代可生成Cu(H2O)2Cl2 , 试画出其具有极性的分子的结构式。(5)、Cu3N的晶胞结构如图所示,N3-的配位数为;若晶胞棱长为anm,NA表示阿伏加德罗常数的值,则Cu3N的密度ρ=g/cm3 [用含a 和NA 的式子表示,Mr(Cu3N)=206]
)碳原子的杂化方式为。 (4)、[Cu(H2O)4]2+为平面正方形结构,其中的两个H2O被Cl-取代可生成Cu(H2O)2Cl2 , 试画出其具有极性的分子的结构式。(5)、Cu3N的晶胞结构如图所示,N3-的配位数为;若晶胞棱长为anm,NA表示阿伏加德罗常数的值,则Cu3N的密度ρ=g/cm3 [用含a 和NA 的式子表示,Mr(Cu3N)=206]
-