四川省攀枝花市2017-2018学年高一上学期化学期末考试试卷
试卷更新日期:2018-04-03 类型:期末考试
一、单选题
-
1. 我国著名化学家侯德榜在20世纪40年代所创立的“侯氏制碱法”誉满全球,其中的“碱”指的是( )A、氢氧化钠 B、碳酸氢钠 C、碳酸钠 D、碳酸钾2. 盛放氢氧化钠固体的试剂瓶上应贴的危险化学品标志是( )A、
 B、
B、 C、
C、 D、
D、 3. 下列物质中,不属于合金的是( )A、青铜 B、不锈钢 C、硬铝 D、水银4. 苹果汁是人们喜爱的饮料。由于此饮料中含有Fe2+ , 现榨的苹果汁在空气中会由淡绿色(Fe2+)变为棕黄色(Fe3+)。若榨汁时加入维生素C,可以有效防止这种现象发生。这说明维生素C具有( )A、还原性 B、氧化性 C、碱性 D、酸性5. 用聚光手电筒照射下列分散系时,能观察到丁达尔效应的是( )A、饱和食盐水 B、氢氧化钙浊液 C、硫酸铜溶液 D、氢氧化铁胶体6. 在空气中长时间放置少量金属钠,最终的产物是( )A、Na2O B、NaOH C、Na2CO3 D、Na2O27. 节日燃放的绚丽焰火与“焰色反应”知识相关。下列说法中正确的是( )A、焰色反应均应透过蓝色钴玻璃观察 B、NaCl与Na2CO3灼烧时火焰颜色相同 C、做焰色反应时可用铜丝蘸取待测物在火焰上灼烧 D、焰色反应后金属丝应用硫酸清洗并在外焰上灼烧至没有颜色,再蘸取其他样品灼烧8. 下列关于铝及其化合物的说法中,不正确的是( )A、铝制餐具适宜用来长时间存放酸性、碱性或咸的食物 B、铝是地壳中储量最丰富的金属元素,在自然界中以化合态形式存在 C、由于铝易生成致密的氧化物薄膜保护内层金属,铝制品在生活中被广泛使用 D、在盛有浑浊泥水的试管中加入少量明矾,充分振荡后静置,上层液体变澄清9. 实验室用下图所示的装置蒸馏海水,下列说法正确的是( )
3. 下列物质中,不属于合金的是( )A、青铜 B、不锈钢 C、硬铝 D、水银4. 苹果汁是人们喜爱的饮料。由于此饮料中含有Fe2+ , 现榨的苹果汁在空气中会由淡绿色(Fe2+)变为棕黄色(Fe3+)。若榨汁时加入维生素C,可以有效防止这种现象发生。这说明维生素C具有( )A、还原性 B、氧化性 C、碱性 D、酸性5. 用聚光手电筒照射下列分散系时,能观察到丁达尔效应的是( )A、饱和食盐水 B、氢氧化钙浊液 C、硫酸铜溶液 D、氢氧化铁胶体6. 在空气中长时间放置少量金属钠,最终的产物是( )A、Na2O B、NaOH C、Na2CO3 D、Na2O27. 节日燃放的绚丽焰火与“焰色反应”知识相关。下列说法中正确的是( )A、焰色反应均应透过蓝色钴玻璃观察 B、NaCl与Na2CO3灼烧时火焰颜色相同 C、做焰色反应时可用铜丝蘸取待测物在火焰上灼烧 D、焰色反应后金属丝应用硫酸清洗并在外焰上灼烧至没有颜色,再蘸取其他样品灼烧8. 下列关于铝及其化合物的说法中,不正确的是( )A、铝制餐具适宜用来长时间存放酸性、碱性或咸的食物 B、铝是地壳中储量最丰富的金属元素,在自然界中以化合态形式存在 C、由于铝易生成致密的氧化物薄膜保护内层金属,铝制品在生活中被广泛使用 D、在盛有浑浊泥水的试管中加入少量明矾,充分振荡后静置,上层液体变澄清9. 实验室用下图所示的装置蒸馏海水,下列说法正确的是( )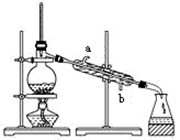 A、蒸馏烧瓶中加入沸石的作用是防止暴沸 B、实验时冷却水应从a进入,从b流出 C、锥形瓶中能收集到高浓度的氯化钠溶液 D、该装置可用于分离海水中的NaCl和MgCl210. 下列各组物质反应后,再滴入KSCN溶液,显红色的是( )A、向CuCl2溶液中加入铁粉 B、向FeO粉末中加入稀硫酸 C、Fe与过量稀盐酸反应后的溶液中再加入少量氯水 D、Fe(OH)3与过量稀盐酸反应后的溶液中再加入过量铁粉11. 下列各反应属于图中阴影部分所示关系的是( )
A、蒸馏烧瓶中加入沸石的作用是防止暴沸 B、实验时冷却水应从a进入,从b流出 C、锥形瓶中能收集到高浓度的氯化钠溶液 D、该装置可用于分离海水中的NaCl和MgCl210. 下列各组物质反应后,再滴入KSCN溶液,显红色的是( )A、向CuCl2溶液中加入铁粉 B、向FeO粉末中加入稀硫酸 C、Fe与过量稀盐酸反应后的溶液中再加入少量氯水 D、Fe(OH)3与过量稀盐酸反应后的溶液中再加入过量铁粉11. 下列各反应属于图中阴影部分所示关系的是( ) A、CO2与Na2CO3溶液 B、白磷在氧气中燃烧 C、氯气与氯化亚铁溶液 D、铜与氯化铁溶液12. 某实验小组通过下图所示实验探究Na2O2与水的反应:
A、CO2与Na2CO3溶液 B、白磷在氧气中燃烧 C、氯气与氯化亚铁溶液 D、铜与氯化铁溶液12. 某实验小组通过下图所示实验探究Na2O2与水的反应: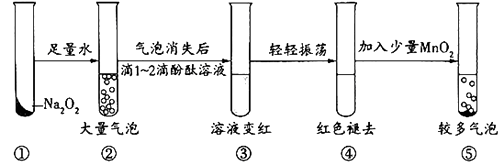
下列说法不正确的是( )
A、②中的大量气泡主要成分是氧气 B、③中溶液变红,说明有碱性物质生成 C、④中现象可能是由于溶液中含有强氧化性物质造成的 D、⑤中MnO2的主要作用是降低了水中氧气的溶解度13. 根据下列有关实验操作、现象,得出的结论或解释正确的是( )选项
实验操作
实验现象
结论或解释
A
用镊子夹取一块金属钠并用滤纸吸干表面的煤油,用小刀切开一端的外皮
切口处呈银白色,很快变暗
常温下,钠与O2反应生成了Na2O2
B
用坩埚钳夹住一块表面用砂纸打磨过的铝箔在酒精灯上加热一会儿
铝箔熔化,但并不滴落
铝的熔点比Al2O3更高
C
做焰色反应实验时,某同学用洁净的铂丝蘸取样品在无色火焰上灼烧
直接观察到火焰的颜色呈黄色
该样品中含有钠元素,一定不含钾元素
D
在两支试管中分别加入等物质的量浓度的Na2CO3和NaHCO3溶液,然后各滴加2滴酚酞
溶液均变成红色,但Na2CO3溶液颜色更深一些
同浓度的Na2CO3溶液碱性更强
A、A B、B C、C D、D14. 下列各组物质中,所含原子数相同的是( )A、5.6LCH4(标准状况)和17.5g N2 B、16gO2和24gO3 C、224mL H2(标准状况)和0.1mol CO2 D、标准状况下,11.2LH2O和0.5molSO215. 某同学设计如下实验方案,用以分离 KCl和BaCl2两种混合物,供选试剂:Na2SO4溶液、K2CO3溶液、K2SO4溶液、盐酸。
下列说法中,正确的是( )
A、试剂 a是K2SO4 溶液 B、试剂 b是盐酸 C、固体 C是BaCl2 D、不加试剂 b,将滤液直接蒸发、结晶,过滤后干燥也能得到纯净的固体C16. 宋代著名的医学家宋慈《洗冤集录》中有“银针验毒”的记载,“银针验毒”的原理是:4Ag + 2H2S + O2=2X(黑色)+ 2H2O,下列说法中,不正确的是( )A、银针验毒时,空气中的氧气得到电子 B、每生成1molX,反应转移2mole- C、氧化剂和还原剂的物质的量之比为1: 4 D、反应中Ag和H2S均为还原剂17. 在真空密闭装置中,亚氯酸钠(NaClO2)固体在一定条件下发生分解反应,不可能形成的产物是( )A、NaCl 和 O2 B、NaClO3 和 NaClO C、NaClO3 和 Cl2 D、NaClO3 和 NaCl18. 用等体积的0.2mol/L的BaCl2 溶液,可使相同体积的Na2SO4、KAl(SO4)2、Fe2(SO4)3三种溶液中的SO42ˉ完全沉淀,则三种硫酸盐的物质的量浓度之比为( )A、6∶3∶1 B、6∶3∶2 C、9∶3∶1 D、12∶3∶219. 含浓度均为0.1mol/L的硫酸、硫酸铜的混合溶液200mL,加入一定质量的锌片,生成气体224mL(标准状况下), 则加入锌片的质量为( )A、0.65g B、1.3g C、1.95g D、2.6g20. 将m g镁铝合金投入到500 mL 2 mol/L的盐酸中,固体完全溶解,收集到气体5.6L(标准状况下)。向反应所得溶液中加入4mol/L的氢氧化钠溶液,沉淀达到最大值为13.60 g,则m的值为( )A、5.10 B、8.50 C、9.35 D、11.48二、填空题
-
21. 写出以下反应的化学方程式:(1)、Na2O2与CO2反应:(2)、加热使NaHCO3分解:(3)、Al与NaOH溶液反应:(4)、Fe(OH)2长时间露置于空气中:
三、综合题
-
22. 标出下列氧化还原反应的电子转移数目和方向,并写出氧化剂(1)、5MnSO4 + 2NaClO3 + 4H2O 5MnO2 + Na2SO4 + Cl2 ↑+ 4H2SO4 , 氧化剂是(2)、2FeCl3 + 10NaOH+ 3NaClO =2Na2FeO4 + 9NaCl + 5H2O , 氧化剂是23. 回答下列问题:(1)、将4molN2和6molO2混合,所得气体在标准状况下的密度是g/L。(2)、有Na2SO4和Fe2(SO4)3的混合溶液中,已知其中c(Fe3+)=0.4mol/L,c(SO42-)=0.7mol/L,则此溶液中c(Na+)=mol/L。(3)、某普通酒精中乙醇的含量为97%,密度为0.90g/cm3 , 将乙醇看作溶剂,水看作溶质,该普通酒精中水的物质的量浓度是 mol/L。24. 某混合物A含有KAl(SO4)2、Al2O3和Fe2O3 , 在一定条件下可实现如图所示的物质之间的变化:

回答下列问题:
(1)、写出所含物质的化学式:固体B , 沉淀D。(2)、写出①、④两个反应的化学方程式:①
④
(3)、写出②、③两个反应的离子方程式:②
③
(4)、设计实验检验溶液F中所含溶质的阳离子:。(5)、分别写出Al2O3和Fe2O3在工业上的一种主要用途:Al2O3︰
Fe2O3︰
25. 镁和铝的碱式碳酸盐是中和胃酸药物的主要成分。欲测定某种镁和铝的碱式碳酸盐的成分进行了以下实验,根据以下实验记录,回答下列问题:(1)、称取6.02g该碱式碳酸盐,加入4.0mol/L盐酸使其溶解,当加入42.5mL时开始产生CO2 , 当加入盐酸至45.0mL时恰好完全溶解,该碱式碳酸盐中OH-与CO32- 的物质的量之比n(OH-)︰n(CO32-)=;(2)、在上述碱式碳酸盐恰好完全溶解所得溶液中加入过量的NaOH溶液,过滤,干燥(不分解)后得3.48g沉淀物。若该碱式碳酸盐中镁元素与氢元素的质量分数之比为6:1,试计算确定该碱式碳酸盐的化学式 。四、实验题
-
26. 实验室现需配制物质的量浓度为1mol/L的NaOH溶液480mL。(1)、配制该溶液的实验步骤包括:
a.计算需要氢氧化钠固体的质量;
b.称量氢氧化钠固体;
c.将烧杯中的溶液注入容量瓶中,洗涤烧杯和玻璃棒,将洗涤液全部转移入容量瓶中;
d.用适量的蒸馏水溶解称量好的氢氧化钠固体,冷却;
e.盖好瓶塞,反复上下颠倒,摇匀;
f.继续向容量瓶中加蒸馏水至刻度线下1~2cm时,改用滴加蒸馏水至凹液面与刻度线相切。
上述步骤的正确操作顺序是。
(2)、使用mL的容量瓶配制此溶液,需要称量NaOH固体的质量为g。(3)、下列操作会使所配制溶液浓度偏大的有________。A、容量瓶中原有少量蒸馏水 B、转移溶液时,没有洗涤玻璃棒和溶解用的烧杯 C、定容摇匀后,静置时发现液面低于刻度线,又加水至刻度线 D、定容时,俯视观察液面27. 四川师范大学化学与材料学院对“铁与水蒸气反应”实验研究的结果显示:在80~100℃能产生稳定水蒸气的物质都可以作为该反应的供水剂;铁与水蒸气反应温度在500℃左右即可顺利进行。某化学兴趣小组同学利用该研究结论,采用西红柿(或洋葱)作为供水剂,设计了如图装置进行实验,并对铁与水蒸气反应的产物进行检验。

回答下列问题:
(1)、A中铁与水蒸气反应的化学方程式是。(2)、C中碱石灰的作用是。(3)、D处实验现象为。(4)、上述实验结束后,取出A中铁粉反应后的少量固体继续进行如下实验:
①加入稀硫酸发生的离子方程式为。
②试剂A是(选填字母),现象2为。
a .NaOH溶液 b. 酸性KMnO4溶液 c .酚酞 d . 氯水
③若用电子天平称取铁粉质量为0.1527g,测得生成氢气体积为73.50mL(实验室条件下气体摩尔体积为24.5L/mol).则参加反应的铁粉占称取铁粉的百分数为(精确到0.1%)。
④有同学认为:即使得到了现象1和现象2的实验现象,也不能确定所得固体成分为Fe3O4。你认为该同学持此看法的理由是。
五、计算题
-
28. 某Na2O2 固体中因吸收CO2 而含有少量Na2CO3 , 经实验测定样品中Na2O2的质量分数为88.0%。现称取该样品8.86g,加入水充分反应后放出气体,所得溶液体积为500mL。试计算:(要求:写出解题过程,计算结果保留两位小数)(1)、上述反应所得气体在标准状况下的体积;(2)、反应后溶液中Na+的物质的量浓度。
-