四川省广安市2017-2018学年高二上学期化学期末考试试卷
试卷更新日期:2018-04-03 类型:期末考试
一、单选题
-
1. 我们现在所使用的能源分为“一次能源”和“二次能源”。根据能源的分类,下列全部属于“一次能源”的是( )A、天然气 蒸汽 风力 B、石油 流水 天然铀矿 C、原煤 核能 电力 D、焦炭 酒精 潮汐能2. 下列各原子或离子的电子排布式错误的是( )A、Mg2+ 1s22s22p6 B、F 1s22s22p5 C、Ar 1s22s22p63s23p6 D、Cr 1s22s22p63s23p63d44s23. 室温下,柠檬水溶液的pH 是3,则其中由水电离出的c(H+)是( )
A、1×10-11 mol·L-1 B、1×10-3 mol·L-1 C、1×10-7mol·L-1 D、0.1 mol·L-14. 一定温度下,反应 N2(g)+O2(g)⇌2NO(g)在密闭容器中进行,下列措施不改变化学反应速率的是( )A、缩小体积使压强增大 B、恒容,充入N2 C、恒容,充入He D、恒压,充入He5. 图中烧杯中盛的是天然水,铁腐蚀的速率由快到慢的顺序是( )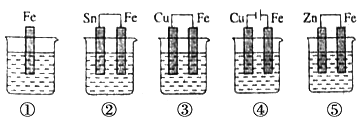 A、⑤>②>①>③>④ B、⑤>②>③>④>① C、④>③>②>①>⑤ D、④>③>⑤>②>①6. 为了除去MgCl2酸性溶液中的Fe3+ , 可在加热搅拌的条件下加入一种试剂,过滤后,再向滤液中加入适量的盐酸,这种试剂不能是( )A、MgO B、Mg(OH)2 C、NH3.H2O D、MgCO37. 准确移取20.00 mL某待测HCl溶液于锥形瓶中,用0.100 0 mol·L-1NaOH溶液滴定。下列说法正确的是( )
A、⑤>②>①>③>④ B、⑤>②>③>④>① C、④>③>②>①>⑤ D、④>③>⑤>②>①6. 为了除去MgCl2酸性溶液中的Fe3+ , 可在加热搅拌的条件下加入一种试剂,过滤后,再向滤液中加入适量的盐酸,这种试剂不能是( )A、MgO B、Mg(OH)2 C、NH3.H2O D、MgCO37. 准确移取20.00 mL某待测HCl溶液于锥形瓶中,用0.100 0 mol·L-1NaOH溶液滴定。下列说法正确的是( )
A、滴定管用蒸馏水洗涤后,装入NaOH溶液进行滴定 B、随着NaOH溶液滴入,锥形瓶中溶液pH由小变大 C、用酚酞作指示剂,当锥形瓶中溶液由红色变无色时停止滴定 D、滴定达终点时,发现滴定管尖嘴部分有悬滴,则测定结果偏小8. 如图所示是一位同学在测试水果电池,下列有关说法错误的是( ) A、若金属片A是正极,则该金属片上会产生H2 B、水果电池的化学能转化为电能 C、此水果发电的原理是电磁感应 D、金属片A、B可以一个是铜片,另一个是铁片9. 下列说法中正确的是( )A、饱和石灰水中加入一定量生石灰,溶液温度明显升高,pH增大 B、AgCl悬浊液中存在平衡:AgCl(s) Ag+(aq)+Cl- (aq),往其中加入少量NaCl粉末,平衡向左移动,溶液中离子的总浓度减小 C、AgCl悬浊液中加入KI溶液,白色沉淀变为黄色,证明此条件下Ksp(AgCl)>Ksp(AgI) D、Na2CO3溶液中:2c(Na+)=c(HCO3-)+c(H2CO3)+c(CO32-)10. 在一密闭容器中,当反应aA(g) bB(g)+cC(g)达到平衡后,保持温度不变,将容器体积增加一倍,最终测得A的物质的量的浓度为原来的55%,则( )A、平衡向正反应方向移动 B、a>b+c C、物质B的质量分数增大 D、以上判断都错误11. 下列关于元素第一电离能的说法不正确的是( )A、钾元素的第一电离能小于钠元素的第一电离能,故钾的活泼性强于钠 B、因同周期元素的原子半径从左到右逐渐减小,故第一电离能必依次增大 C、最外层电子排布为ns2np6(若只有K层时为1s2)的原子,第一电离能较大 D、对于同一元素而言,原子的逐级电离能越来越大12. 环保、安全的铝空气电池的工作原理如图所示,下列有关叙述错误的是( )
A、若金属片A是正极,则该金属片上会产生H2 B、水果电池的化学能转化为电能 C、此水果发电的原理是电磁感应 D、金属片A、B可以一个是铜片,另一个是铁片9. 下列说法中正确的是( )A、饱和石灰水中加入一定量生石灰,溶液温度明显升高,pH增大 B、AgCl悬浊液中存在平衡:AgCl(s) Ag+(aq)+Cl- (aq),往其中加入少量NaCl粉末,平衡向左移动,溶液中离子的总浓度减小 C、AgCl悬浊液中加入KI溶液,白色沉淀变为黄色,证明此条件下Ksp(AgCl)>Ksp(AgI) D、Na2CO3溶液中:2c(Na+)=c(HCO3-)+c(H2CO3)+c(CO32-)10. 在一密闭容器中,当反应aA(g) bB(g)+cC(g)达到平衡后,保持温度不变,将容器体积增加一倍,最终测得A的物质的量的浓度为原来的55%,则( )A、平衡向正反应方向移动 B、a>b+c C、物质B的质量分数增大 D、以上判断都错误11. 下列关于元素第一电离能的说法不正确的是( )A、钾元素的第一电离能小于钠元素的第一电离能,故钾的活泼性强于钠 B、因同周期元素的原子半径从左到右逐渐减小,故第一电离能必依次增大 C、最外层电子排布为ns2np6(若只有K层时为1s2)的原子,第一电离能较大 D、对于同一元素而言,原子的逐级电离能越来越大12. 环保、安全的铝空气电池的工作原理如图所示,下列有关叙述错误的是( ) A、NaCl的作用是增强溶液的导电性 B、正极的电极反应式为O2+4e-+2H2O=4OH- C、电池工作过程中,电解质溶液的pH不断增大 D、用该电池做电源电解KI溶液制取1 mol KIO3 , 消耗铝电极的质量为54 g13. 在一定温度下的定容容器中,当下列物理量不再变化时,能说明I2(g)+H2(g) 2HI(g)达到平衡状态的是( )A、混合气体的颜色 B、容器内压强 C、混合气体的平均相对分子质量 D、混合气体的密度14. 现有室温下四种溶液,有关叙述不正确的是( )
A、NaCl的作用是增强溶液的导电性 B、正极的电极反应式为O2+4e-+2H2O=4OH- C、电池工作过程中,电解质溶液的pH不断增大 D、用该电池做电源电解KI溶液制取1 mol KIO3 , 消耗铝电极的质量为54 g13. 在一定温度下的定容容器中,当下列物理量不再变化时,能说明I2(g)+H2(g) 2HI(g)达到平衡状态的是( )A、混合气体的颜色 B、容器内压强 C、混合气体的平均相对分子质量 D、混合气体的密度14. 现有室温下四种溶液,有关叙述不正确的是( )序号
①
②
③
④
溶液
氨水
氢氧化钠溶液
醋酸
盐酸
pH
11
11
3
3
A、③④中分别加入适量的醋酸钠晶体后,两溶液的pH均增大 B、②③两溶液等体积混合,所得溶液中c(H+)>c(OH-) C、V1L④和V2L②混合,若混合后溶液pH=7,则V1=V2 D、分别加水稀释10倍,四种溶液的pH:①>②>③>④15. 已知:CO(g)+H2O(g) CO2(g)+H2(g) ΔH=-41 kJ·mol-1。相同温度下,在体积相同的两个恒温密闭容器中,加入一定量的反应物发生反应。相关数据如下:
容器
编号
起始时各物质的物质的量/mol
达平衡过程体系的能量变化
CO
H2O
CO2
H2O
①
1
4
0
0
放出热量:32.8 kJ
②
0
0
1
4
热量变化:Q
下列说法中,不正确的是( )
A、容器①中反应达平衡时,CO的转化率为80% B、容器①中CO的转化率等于容器②中CO2的转化率 C、容器①中CO反应速率等于H2O的反应速率 D、平衡时,两容器中CO2的浓度相等16. 浓度均为0.1mol·L-1,体积均为V0的HX、HY溶液,分别加水稀释至体积V,pH随lg 的变化关系如图所示。下列叙述正确的是( ) A、相同温度下,电离常数K(HX):a>b B、HX、HY都是弱酸,且HX的酸性比HY的弱 C、常温下,由水电离出的c(H+)•c(OH-):a<b D、lg =3,若同时微热两种溶液(不考虑HX、HY和H2O的挥发),则 减小17. 汽车净化的主要原理为2NO(g)+2CO(g) 2CO2(g)+N2(g) △H<0。若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且说明反应在进行到t1时刻达到平衡状态的是( )A、
A、相同温度下,电离常数K(HX):a>b B、HX、HY都是弱酸,且HX的酸性比HY的弱 C、常温下,由水电离出的c(H+)•c(OH-):a<b D、lg =3,若同时微热两种溶液(不考虑HX、HY和H2O的挥发),则 减小17. 汽车净化的主要原理为2NO(g)+2CO(g) 2CO2(g)+N2(g) △H<0。若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且说明反应在进行到t1时刻达到平衡状态的是( )A、 B、
B、 C、
C、 D、
D、 18. 500mLKNO3和Cu(NO3)2的混合溶液中c(NO3-)=0.6mol·L-1 , 用石墨作电极电解此溶液,当通电一段时间后,两极均收集到2.24L气体(标准状况下),假定电解后溶液体积仍为500mL,下列说法正确的是( )A、上述电解过程中共转移0.2mol电子 B、原混合溶液中c(K+)为0.2mol·L-1 C、电解得到的Cu的物质的量为0.05mol D、电解后溶液中c(H+)为0.2mol·L-1
18. 500mLKNO3和Cu(NO3)2的混合溶液中c(NO3-)=0.6mol·L-1 , 用石墨作电极电解此溶液,当通电一段时间后,两极均收集到2.24L气体(标准状况下),假定电解后溶液体积仍为500mL,下列说法正确的是( )A、上述电解过程中共转移0.2mol电子 B、原混合溶液中c(K+)为0.2mol·L-1 C、电解得到的Cu的物质的量为0.05mol D、电解后溶液中c(H+)为0.2mol·L-1二、综合题
-
19. 向一容积不变的密闭容器中充入一定量A(g)和B,发生反应:xA(g) +2B(s) yC(g) △H<0.在一定条件下,容器中A、C 的物质的量浓度随时间变化的曲线如图所示。

请回答下列问题
(1)、根据图示可确定x:y=。(2)、0 -10min容器内压强 (填“变大”、“ 不变”或“变小”)(3)、推测第10min引起曲线变化的反应条件可能是(填编号,下同);第16min引起曲线变化的反应条件可能是。①减压 ② 增大A的浓度 ③增大C的量 ④升温 ⑤ 降温⑥ 加催化剂
(4)、若平衡1的平衡常数为K1 , 平衡II的平衡常数为K2 , 则K1(填“>”“=”或“<”)K220. 某实验小组同学利用下图装置对电化学原理进行了一系列探究活动。 (1)、甲池为装置(填“原电池”或“电解池”)。(2)、甲池反应前,两电极质量相等,一段时间后,两电极质量相差28g,导线中通过mol电子。(3)、实验过程中,甲池左侧烧杯中NO3-的浓度(填“变大”、“变小”或“不变”)。(4)、其他条件不变,若用U形铜棒代替“盐桥”,工作一段时间后取出铜棒称量,质量(填“变大”、“变小”或“不变”)。若乙池中的某盐溶液是足量AgNO3溶液,则乙池中左侧Pt电极反应式为 , 工作一段时间后,若要使乙池溶液恢复原来浓度,可向溶液中加入(填化学式)。21. 某探究性学习实验小组做了如下实验:
(1)、甲池为装置(填“原电池”或“电解池”)。(2)、甲池反应前,两电极质量相等,一段时间后,两电极质量相差28g,导线中通过mol电子。(3)、实验过程中,甲池左侧烧杯中NO3-的浓度(填“变大”、“变小”或“不变”)。(4)、其他条件不变,若用U形铜棒代替“盐桥”,工作一段时间后取出铜棒称量,质量(填“变大”、“变小”或“不变”)。若乙池中的某盐溶液是足量AgNO3溶液,则乙池中左侧Pt电极反应式为 , 工作一段时间后,若要使乙池溶液恢复原来浓度,可向溶液中加入(填化学式)。21. 某探究性学习实验小组做了如下实验:实验一:利用H2C2O4 溶液和酸性KMnO4溶液之间的反应来探究“外界条件改变对化学反应速率的影响”,实验如下:
实验序号
试验温度/K
溶液颜色褪至无色时所需时间/s
KMnO4溶液(含硫酸)
H2C2O4溶液
H2O
V/mL
c/mol·L-1
V/mL
c/mol·L-1
V/mL
A
293
2
0.02
5
0.1
3
t1
B
T1
2
0.02
3
0.1
V1
8
C
313
2
0.02
V2
0.1
5
t1
(1)、通过实验A、B,可探究出 (填外部因素)的改变对反应速率的影响,其中V1= , T1=;通过实验可探究出温度变化对化学反应速率的影响。(2)、若t1<8,则由此实验可以得出的结论是;利用实验B 中数据计算,用KMnO4的浓度变化表示的反应速率为v(KMnO4)= 。(3)、实验二:探究酸的强弱对酸与镁条反应速率的影响。实验步骤:


(a)检查装置的气密性后,添加药品;
(b)反应开始后,每隔1min 记录一次生成H2的体积;
(c)将所记录的数据转化为曲线图(上图乙)。
根据反应的图像(图乙)分析:0-lmin盐酸与镁反应比1-2min反应快的原因:。
(4)、对照实验:用20mL 水代替酸进行实验。实验现象: 当水滴入锥形瓶中,注射器的活塞(填“会”或“不会”)向右移动。
问题分析:针对上述现象,上图中气体发生装置是否合理:(填“合理”或“不合理”)若合理,则忽略下问;若不合理,请改进上述装置使其变成合理的装置图: (用必要的文字或装置图进行回答)。
22. 软锰矿的主要成分是MnO2 , 还含有少量(Hg2+等)重金属化合物杂质。黄铁矿的主要成分是FeS2 , 还含有SiO2和Al2O3等杂质。工业上采用同槽硫酸酸溶等工艺制备碳酸锰并回收硫酸铵,其主要流程如下:( 已知: Ksp[Al(OH) 3]=1 3×10-33 , Ksp[Fe(OH) 3]=5.3×10-38 , 金属离子的浓度小于1×10-6视为沉淀完全。) (1)、为了提高锰元素的浸出率,在“浸取”时可采取的措施有:
(1)、为了提高锰元素的浸出率,在“浸取”时可采取的措施有:①适当升高温度,②搅拌,③等。
(2)、流程“氧化”中加入MnO2与Fe2+发生反应的离子方程式为。(3)、“滤渣2”中主要成分的化学式为。(4)、流程“除重金属”时使用(NH4)2S而不使用Na2S的原因是。(5)、流程“50℃碳化”得到碳酸锰,该反应的化学方程式为。(6)、生成的碳酸锰产品需经充分洗涤,检验产品完全洗净的方法是。