江苏省盐城市2017-2018学年高二上学期化学期末考试试卷
试卷更新日期:2018-04-03 类型:期末考试
一、单选题
-
1. 三位欧洲科学家因发展冷冻电镜技术而分享了2017年诺贝尔化学奖,利用该技术可以解析生物大(高)分子原子结构模型。下列不属于生物大分子的是( )A、油脂 B、淀粉 C、纤维素 D、蛋白质2. 我国科学家预言的T-碳(四个碳原子构成的正四面体分别取代金刚石结构中所有碳原子,如下图)最近在实验室成功合成。T-碳属于( )
 A、混合物 B、化合物 C、氧化物 D、单质3. 在新药开发等领域用途十分广泛。这里的“13”是指该原子的( )A、质子数 B、中子数 C、质量数 D、电子数4. 下列诗句描述的过程中包含化学变化的是( )A、宝剑锋从磨砺出 B、蜡烛对烧红泪乾 C、风吹柳花满店香 D、玉碗冰寒滴露华5. 下列物质中含有离子键的是( )A、CO2 B、NaF C、HCl D、NH36. 下列常见物质的俗名与化学式对应正确的是( )A、纯碱——NaOH B、生石灰——CaCO3 C、可燃冰——CO2 D、石英——SiO27. 下列化学用语表示正确的是( )A、苯的结构式:C6H6 B、H2O的电子式:
A、混合物 B、化合物 C、氧化物 D、单质3. 在新药开发等领域用途十分广泛。这里的“13”是指该原子的( )A、质子数 B、中子数 C、质量数 D、电子数4. 下列诗句描述的过程中包含化学变化的是( )A、宝剑锋从磨砺出 B、蜡烛对烧红泪乾 C、风吹柳花满店香 D、玉碗冰寒滴露华5. 下列物质中含有离子键的是( )A、CO2 B、NaF C、HCl D、NH36. 下列常见物质的俗名与化学式对应正确的是( )A、纯碱——NaOH B、生石灰——CaCO3 C、可燃冰——CO2 D、石英——SiO27. 下列化学用语表示正确的是( )A、苯的结构式:C6H6 B、H2O的电子式: C、Mg2+的结构示意图:
C、Mg2+的结构示意图:  D、硝酸的电离方程式:HNO3 = H+ + NO3-
8. 下列气体可用如图所示方法收集的是( )
D、硝酸的电离方程式:HNO3 = H+ + NO3-
8. 下列气体可用如图所示方法收集的是( ) A、H2 B、CO2 C、NO D、NH39. 反应2SO2+O2 2SO3在密闭容器中进行。下列关于该反应的说法正确的是( )A、增大压强能减慢反应速率 B、升高温度能减慢反应速率 C、使用恰当的催化剂能加快反应速率 D、0.2molSO2与0.1mol O2充分反应生成0.2molSO310. 在含有大量Ba2+、OH-、Cl-的溶液中,还可能大量共存的离子是( )A、NH4+ B、SO42- C、Mg2+ D、NO3-11. 下列反应属于置换反应的是( )A、2C +SiO2 Si + 2CO↑ B、Na2CO3+CO2+H2O=2NaHCO3 C、2H2O2 2H2O + O2↑ D、Fe(OH)3 + 3HCl = FeCl3 +3H2O12. 下列过程吸收热量的是( )A、液氨气化 B、生石灰加入水中 C、天然气燃烧 D、盐酸与氢氧化钾溶液反应13. 下列有关苯和乙烯的说法正确的是( )A、均易溶于水 B、均含有碳碳双键 C、均能发生加成反应 D、均能使酸性KMnO4溶液褪色14. 用下图所示装置萃取溴水中的溴,下列说法正确的是( )
A、H2 B、CO2 C、NO D、NH39. 反应2SO2+O2 2SO3在密闭容器中进行。下列关于该反应的说法正确的是( )A、增大压强能减慢反应速率 B、升高温度能减慢反应速率 C、使用恰当的催化剂能加快反应速率 D、0.2molSO2与0.1mol O2充分反应生成0.2molSO310. 在含有大量Ba2+、OH-、Cl-的溶液中,还可能大量共存的离子是( )A、NH4+ B、SO42- C、Mg2+ D、NO3-11. 下列反应属于置换反应的是( )A、2C +SiO2 Si + 2CO↑ B、Na2CO3+CO2+H2O=2NaHCO3 C、2H2O2 2H2O + O2↑ D、Fe(OH)3 + 3HCl = FeCl3 +3H2O12. 下列过程吸收热量的是( )A、液氨气化 B、生石灰加入水中 C、天然气燃烧 D、盐酸与氢氧化钾溶液反应13. 下列有关苯和乙烯的说法正确的是( )A、均易溶于水 B、均含有碳碳双键 C、均能发生加成反应 D、均能使酸性KMnO4溶液褪色14. 用下图所示装置萃取溴水中的溴,下列说法正确的是( ) A、使用前不需要检查分液漏斗是否漏液 B、萃取剂可用酒精或CCl4 C、“振荡”后立刻进行分液 D、分液时,先从分液漏斗下口放出下层液体,关闭旋塞,再从上口倒出上层液体15. 我国已经成功研制出性能先进的铼镍合金单晶涡轮叶片。冶炼铼(Re)的主要反应为:2 NH4ReO4+ 7H2 2 Re + 2NH3 + 8H2O。下列说法正确的是( )A、H2是氧化剂 B、H2发生还原反应 C、NH4ReO4在反应中得到电子 D、NH4ReO4在反应中被氧化16. 下列说法正确的是( )A、可用品红溶液检验SO2 B、常温下,可用铝罐贮运稀硝酸 C、NaOH溶液可长期贮存在带玻璃塞的试剂瓶中 D、常温常压下,22.4LN2含有氮原子数为2×6.02×102317. 下列反应的离子方程式书写正确的是( )A、钠与水反应:Na+2H2O=Na++2OH-+H2↑ B、FeCl2溶液与Cl2反应:Fe2++Cl2=Fe3++2Cl- C、Cu(OH)2与稀HNO3反应:Cu(OH)2 + 2H+= Cu2+ +2H2O D、CaCO3与CH3COOH反应:CaCO3+2H+ = Ca2+ +CO2↑+H2O18. 下列有关浓硫酸的说法正确的是( )A、具有脱水性 B、密度比水小 C、可干燥NH3 D、加热时与铜不反应19. 下列方案不能达到实验目的的是( )A、用碘水鉴别淀粉溶液和食盐水 B、用澄清石灰水鉴别Na2CO3和NaHCO3溶液 C、用丁达尔效应鉴别FeCl3溶液和Fe(OH)3胶体 D、除去Cl2中HCl,将混合气体依次通过饱和食盐水和浓硫酸20. 下图是铝-空气电池的示意图。该电池工作时,下列说法正确的是( )
A、使用前不需要检查分液漏斗是否漏液 B、萃取剂可用酒精或CCl4 C、“振荡”后立刻进行分液 D、分液时,先从分液漏斗下口放出下层液体,关闭旋塞,再从上口倒出上层液体15. 我国已经成功研制出性能先进的铼镍合金单晶涡轮叶片。冶炼铼(Re)的主要反应为:2 NH4ReO4+ 7H2 2 Re + 2NH3 + 8H2O。下列说法正确的是( )A、H2是氧化剂 B、H2发生还原反应 C、NH4ReO4在反应中得到电子 D、NH4ReO4在反应中被氧化16. 下列说法正确的是( )A、可用品红溶液检验SO2 B、常温下,可用铝罐贮运稀硝酸 C、NaOH溶液可长期贮存在带玻璃塞的试剂瓶中 D、常温常压下,22.4LN2含有氮原子数为2×6.02×102317. 下列反应的离子方程式书写正确的是( )A、钠与水反应:Na+2H2O=Na++2OH-+H2↑ B、FeCl2溶液与Cl2反应:Fe2++Cl2=Fe3++2Cl- C、Cu(OH)2与稀HNO3反应:Cu(OH)2 + 2H+= Cu2+ +2H2O D、CaCO3与CH3COOH反应:CaCO3+2H+ = Ca2+ +CO2↑+H2O18. 下列有关浓硫酸的说法正确的是( )A、具有脱水性 B、密度比水小 C、可干燥NH3 D、加热时与铜不反应19. 下列方案不能达到实验目的的是( )A、用碘水鉴别淀粉溶液和食盐水 B、用澄清石灰水鉴别Na2CO3和NaHCO3溶液 C、用丁达尔效应鉴别FeCl3溶液和Fe(OH)3胶体 D、除去Cl2中HCl,将混合气体依次通过饱和食盐水和浓硫酸20. 下图是铝-空气电池的示意图。该电池工作时,下列说法正确的是( )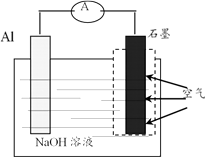 A、铝片作正极 B、电子由石墨沿导线流向Al片 C、铝片质量不断减少 D、实现了电能向化学能转化21. 下列化学方程式书写正确的是( )A、CH4 + Cl2 CH2Cl2+H2 B、CH2=CH2 + Br2 → CH3CHBr2 C、2CH3CH2OH + O2 2CH3CHO +2H2O D、22. X、Y、Z、W为原子序数依次增大的短周期主族元素。X、Y最外层电子数之和与Z的最外层电子数相等;X、W在周期表中所处的周期数均等于其族序数;Y、Z相邻且Y的最低负价的绝对值与W的最高正价数值相等。下列说法正确的是( )A、原子半径:r(X)<r(Y)<r(Z)<r(W) B、Y的简单气态氢化物的热稳定性比Z的弱 C、X、Y、Z三种元素组成的化合物的水溶液一定能使石蕊溶液变红 D、W的氧化物只能与强酸反应,不能与强碱反应23. 某黑色粉末可能含有FeO、CuO、Fe、C中的三种或三种以上,根据下列实验事实得出的结论正确的是( )A、取少量固体加入浓硫酸并加热,固体完全溶解,说明原固体中一定没有C B、取5.0g固体在氧气流中充分灼烧,灼烧后固体仍为5.0g,说明原固体中一定含有C C、取少量固体加入足量稀硝酸后,滴入KSCN,溶液变红,说明原固体中一定含有FeO D、称取一定量固体加入足量稀硫酸,充分反应,收集到224mL(标准状况)气体,过滤,所得滤渣经干燥后称得质量为0.64g,原固体中一定含有Fe和CuO且n(Fe) ∶n(CuO) =2∶1
A、铝片作正极 B、电子由石墨沿导线流向Al片 C、铝片质量不断减少 D、实现了电能向化学能转化21. 下列化学方程式书写正确的是( )A、CH4 + Cl2 CH2Cl2+H2 B、CH2=CH2 + Br2 → CH3CHBr2 C、2CH3CH2OH + O2 2CH3CHO +2H2O D、22. X、Y、Z、W为原子序数依次增大的短周期主族元素。X、Y最外层电子数之和与Z的最外层电子数相等;X、W在周期表中所处的周期数均等于其族序数;Y、Z相邻且Y的最低负价的绝对值与W的最高正价数值相等。下列说法正确的是( )A、原子半径:r(X)<r(Y)<r(Z)<r(W) B、Y的简单气态氢化物的热稳定性比Z的弱 C、X、Y、Z三种元素组成的化合物的水溶液一定能使石蕊溶液变红 D、W的氧化物只能与强酸反应,不能与强碱反应23. 某黑色粉末可能含有FeO、CuO、Fe、C中的三种或三种以上,根据下列实验事实得出的结论正确的是( )A、取少量固体加入浓硫酸并加热,固体完全溶解,说明原固体中一定没有C B、取5.0g固体在氧气流中充分灼烧,灼烧后固体仍为5.0g,说明原固体中一定含有C C、取少量固体加入足量稀硝酸后,滴入KSCN,溶液变红,说明原固体中一定含有FeO D、称取一定量固体加入足量稀硫酸,充分反应,收集到224mL(标准状况)气体,过滤,所得滤渣经干燥后称得质量为0.64g,原固体中一定含有Fe和CuO且n(Fe) ∶n(CuO) =2∶1二、综合题
-
24.(1)、我国首艘国产航母于2017年4月顺利下水。制造航母需使用大量特种钢材、复合材料及光纤等。

①HSLA-100是一种航母甲板用钢,不属于这种钢材性质的是(填字母)。
a.强度大 b.耐高温 c.密度小
②航母拦阻索最初由剑麻纤维和钢丝编织而成,现以尼龙和钢丝编织为主,下一代采用材质将是碳纤维。下列属于天然高分子材料的是(填字母)。
a.剑麻纤维 b.尼龙 c.碳纤维
③航母信息系统上大量使用光导纤维,光导纤维的成分是(填字母)。
a.3CaO·SiO2 b.SiO2 c.聚异戊二烯
(2)、压缩鱼粉是由鱼粉、淀粉、水、山梨酸钾等配料加工而成,鱼粉中含有丰富的蛋白质、维生素及矿物元素钙、锌、硒、磷等。①配料中,属于防腐剂的是(填名称);钙、锌、硒、磷四种元素中属于微量元素的是(填元素名称)。
②鱼粉蛋白质水解能生成多种氨基酸,写出甘氨酸的结构简式:。
③配料中淀粉在人体中完全水解的化学方程式为。
(3)、化学科学与污染防治及绿色发展密切相关。①用清洁能源替代传统的化石能源是预防酸雨的有效途径之一。通常人们所说的酸雨,其主要有害成分是(填两种强酸的化学式);积极推广可降解塑料,减少使用聚乙烯等塑料,可防治的环境污染称为。
②纳米铁可修复被C2HCl3、NO 污染的地下水。C2HCl3在纳米铁作用下,Cl被H取代最终转化为一种气态烃,该气态烃的结构简式为;NO3-在酸性条件下被纳米铁还原为N2(Fe被氧化为Fe2+)的离子方程式为。
③绿色合成是从源头上防治污染的前沿学科。水杨酸与(CH3CO)2O在绿色催化剂明矾催化下可生成阿司匹林和乙酸,该反应的化学方程式为。
25.(1)、官能团与有机物的性质密切相关。①下列物质易溶于水的是(填字母)。
a.异丁烷 b.乙醇 c.氯乙烯
②下列物质不能发生水解反应的是(填字母)。
a.葡萄糖 b.溴乙烷 c.乙酸乙酯
③可用酸性KMnO4溶液鉴别的一组物质是(填字母)。
a.甲烷与乙烷 b.乙烯与乙炔 c.苯和甲苯
(2)、对香豆酸的结构简式如右图所示。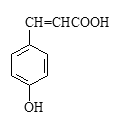
①对香豆酸分子中位于同一平面的碳原子最多有个。
②1mol对香豆酸最多可与 molH2发生加成反应。
③聚对香豆酸的结构简式为。
(3)、D(胡椒醛)是一种食品香料,以A为原料制备D的一种合成路线如下:
①A→B的反应类型是;C中的含氧官能团名称为和(填二种)。
②X的分子式为C2H2O3 , B→C为加成反应,X的结构简式为。
③芳香化合物Y是D的同分异构体,Y既能与NaHCO3反应生成CO2又能发生银镜反应,苯环上的一硝基取代物只有二种。符合题意的Y的结构简式为。
26. 有关物质的转化关系如下图所示(部分生成物和反应条件已略去)。B的焰色反应呈黄色,C、D、E、G是常见的气体, C 、D、E是单质且C呈黄绿色;H与G的组成元素相同,H的摩尔质量为32g·mol-1 , I是常见的盐类,J是紫红色金属单质。 (1)、D的化学式为。(2)、G的电子式为。(3)、写出反应①的离子方程式:。(4)、写出反应②的化学方程式:。27. 草酸亚铁(FeC2O4·2H2O)可用于制备磷酸铁锂电池正极材料。实验室制备草酸亚铁并测定其组成的实验流程如下:
(1)、D的化学式为。(2)、G的电子式为。(3)、写出反应①的离子方程式:。(4)、写出反应②的化学方程式:。27. 草酸亚铁(FeC2O4·2H2O)可用于制备磷酸铁锂电池正极材料。实验室制备草酸亚铁并测定其组成的实验流程如下: (1)、“溶解”时加热的目的是;“沉铁”时将溶液煮沸并在不断搅拌下加入H2C2O4溶液,“不断搅拌”除可使反应物充分接触外,另一目的是。(2)、“过滤、洗涤”时,能说明沉淀已洗涤干净的依据是。(3)、按以下步骤可以测定产品中草酸根的质量分数。
(1)、“溶解”时加热的目的是;“沉铁”时将溶液煮沸并在不断搅拌下加入H2C2O4溶液,“不断搅拌”除可使反应物充分接触外,另一目的是。(2)、“过滤、洗涤”时,能说明沉淀已洗涤干净的依据是。(3)、按以下步骤可以测定产品中草酸根的质量分数。①称取0.1600g草酸亚铁于锥形瓶中,加入25mL 2 mol·L-1的H2SO4溶液,加热至40~50℃,使样品溶解。
②用0.02000 mol·L-1KMnO4溶液滴定至终点,消耗KMnO4溶液23.80mL。
[5C2O42-+ 2MnO4-+16H+=10CO2↑+2Mn2++8H2O ;5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O]
③在②滴定后的溶液中加入足量Zn粉(2Fe3++Zn = 2Fe2++Zn2+)和5mL 2 mol·L-1 的H2SO4溶液,煮沸约10min。
④将滤液过滤至另一个锥形瓶中,用10mL 1 mol·L-1的H2SO4溶液洗涤锥形瓶,将全部Fe2+转移入锥形瓶中,再用0.02000 mol·L-1KMnO4溶液滴定至终点,消耗KMnO4溶液体积8.00 mL。
(I)测得的产品中n(Fe ) ∶n(C2O ) 1∶1(填“>” “=”或“<”)。
(II)请计算产品中C2O 的质量分数(写出计算过程)。