江苏省宿迁市2017-2018学年高一上学期化学期末考试试卷
试卷更新日期:2018-04-03 类型:期末考试
一、单选题
-
1. 秋冬季节往往会出现大雾天气。雾属于下列分散系中的( )A、溶液 B、悬浊液 C、乳浊液 D、胶体2. 硅酸钠的水溶液俗称“水玻璃”,是建筑行业经常使用的一种黏合剂。硅酸钠属于( )A、酸 B、碱 C、盐 D、氧化物3. 下列物质属于非电解质的是( )A、Cl2 B、CO2 C、H2SO4 D、Na2SO44. 可用于治疗甲亢,这里的“53”是指该原子的( )
A、质子数 B、中子数 C、质量数 D、原子数5. 在容量瓶上,没有标记符号的是( )A、标线 B、温度 C、浓度 D、容量6. 合金具有许多优良的性能。下列物质不属于合金的是( )A、钢 B、水银 C、黄铜 D、青铜7. 下列说法正确的是( )A、氢气的摩尔质量是2g B、摩尔是物质的质量单位 C、1 mol OH-的质量是17g D、1mol气体所占的体积约为22.4L8. 下列物质在水溶液中的电离方程式正确的是( )A、H2SO4=H2++SO42- B、Na2CO3=Na++CO32- C、Ca(OH)2=Ca2++OH2- D、NaHSO4=Na++H++SO42-9. 除去Cl2中混有的少量的HCl气体,最好选用( )
A、H2O B、饱和NaCl溶液 C、Na2CO3溶液 D、NaOH溶液10. 下列有关物质用途的说法正确的是( )A、稀硫酸用于除铁锈 B、碳酸钠用于治疗胃酸过多 C、晶体硅用于制造光导纤维 D、硫酸钡用于制作石膏绷带11. 下列有关图示实验正确的是( )A、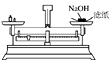 称量NaOH固体
B、
称量NaOH固体
B、 干燥Cl2
C、
干燥Cl2
C、 稀释浓硫酸
D、
稀释浓硫酸
D、 石油的分馏
12. 用NA表示阿伏加德罗常数的值。下列判断正确的是( )A、44g N2O含有的N原子数目为NA B、常温常压下,22.4 L N2含有的分子数目为NA C、1mol Mg变为Mg2+时失去的电子数目为2NA D、1L 1mol·L-1 K2CO3溶液中含有的 K+ 数目为NA13. 某溶液中存在大量的H+、Ba2+、Cl- , 该溶液中还可能大量存在的离子是( )A、OH- B、K+ C、Ag+ D、SO42-14. 下列溶液中的 c(Cl-)与 150mL 1 mol·L-1 AlCl3 溶液中的 c(Cl-)相等的是( )A、450mL 1mol·L-1的 NaCl 溶液 B、75mL 1mol·L-1的FeCl3溶液 C、150mL 3mol·L-1的KClO3溶液 D、75mL 2mol·L-1的NH4Cl溶液15. 下列反应的离子方程式书写正确的是( )A、氢氧化钡溶液和稀硫酸反应:Ba2+ + SO42-=BaSO4↓ B、铁与稀硫酸反应: 2Fe + 6H+ =2Fe3+ + 3H2↑ C、稀醋酸加入到氢氧化钡溶液中:H+ + OH-=H2O D、氯化铝溶液中加入过量氨水:Al3+ + 3NH3·H2O=Al(OH)3↓+ 3 NH4+16. FeO、Fe3O4广泛用于热化学循环分解水制取氢气。已知:①H2O(g)+3FeO=Fe3O4+H2(g) ②2Fe3O4 6FeO+O2(g)。下列说法正确的是( )A、反应①中Fe元素被氧化,反应②中Fe元素被还原 B、反应①中H2O既不是氧化剂也不是还原剂 C、反应②中Fe3O4仅被氧化 D、反应①②中FeO都体现了还原性17. 下列有关浓硫酸说法正确的是( )A、保存在棕色瓶中 B、易挥发 C、能用于干燥SO2 D、常温下与铁不反应18. 在铜与稀HNO3的反应中,若有1mol HNO3被还原,则参加反应的铜的物质的量为( )
石油的分馏
12. 用NA表示阿伏加德罗常数的值。下列判断正确的是( )A、44g N2O含有的N原子数目为NA B、常温常压下,22.4 L N2含有的分子数目为NA C、1mol Mg变为Mg2+时失去的电子数目为2NA D、1L 1mol·L-1 K2CO3溶液中含有的 K+ 数目为NA13. 某溶液中存在大量的H+、Ba2+、Cl- , 该溶液中还可能大量存在的离子是( )A、OH- B、K+ C、Ag+ D、SO42-14. 下列溶液中的 c(Cl-)与 150mL 1 mol·L-1 AlCl3 溶液中的 c(Cl-)相等的是( )A、450mL 1mol·L-1的 NaCl 溶液 B、75mL 1mol·L-1的FeCl3溶液 C、150mL 3mol·L-1的KClO3溶液 D、75mL 2mol·L-1的NH4Cl溶液15. 下列反应的离子方程式书写正确的是( )A、氢氧化钡溶液和稀硫酸反应:Ba2+ + SO42-=BaSO4↓ B、铁与稀硫酸反应: 2Fe + 6H+ =2Fe3+ + 3H2↑ C、稀醋酸加入到氢氧化钡溶液中:H+ + OH-=H2O D、氯化铝溶液中加入过量氨水:Al3+ + 3NH3·H2O=Al(OH)3↓+ 3 NH4+16. FeO、Fe3O4广泛用于热化学循环分解水制取氢气。已知:①H2O(g)+3FeO=Fe3O4+H2(g) ②2Fe3O4 6FeO+O2(g)。下列说法正确的是( )A、反应①中Fe元素被氧化,反应②中Fe元素被还原 B、反应①中H2O既不是氧化剂也不是还原剂 C、反应②中Fe3O4仅被氧化 D、反应①②中FeO都体现了还原性17. 下列有关浓硫酸说法正确的是( )A、保存在棕色瓶中 B、易挥发 C、能用于干燥SO2 D、常温下与铁不反应18. 在铜与稀HNO3的反应中,若有1mol HNO3被还原,则参加反应的铜的物质的量为( )
A、8/3mol B、3/8mol C、3/2mol D、3mol19. 下列物质的转化在给定条件下能实现的是( )A、 B、 C、 D、20. 向CuSO4和Fe2(SO4)3的混合溶液中加入一定质量的铁粉,充分反应后过滤,向滤渣中加入稀盐酸,无明显现象,下列叙述中正确的是
A、滤液中一定无Fe3+ B、滤液中一定有Fe3+ C、滤液中一定无Cu2+ D、滤液中一定有Cu2+二、实验题
-
21. 观察下列实验装置图,回答问题:
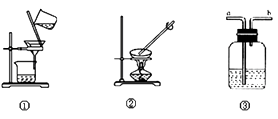
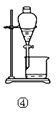 (1)、石灰水长时间露置于空气中,溶液表面会产生一层“膜”,“膜”物质的化学式是 , 可用上图中装置(填序号)进行相关实验操作除去膜物质。(2)、提纯含有少量NaCl的KNO3 , 可将混合物溶解在热水中形成饱和溶液,然后在②装置中进行蒸发浓缩,后进行过滤、、干燥。(3)、实验室制Cl2用装置③吸收尾气,集气瓶中可放入溶液,尾气应从通入(填a、b)。
(1)、石灰水长时间露置于空气中,溶液表面会产生一层“膜”,“膜”物质的化学式是 , 可用上图中装置(填序号)进行相关实验操作除去膜物质。(2)、提纯含有少量NaCl的KNO3 , 可将混合物溶解在热水中形成饱和溶液,然后在②装置中进行蒸发浓缩,后进行过滤、、干燥。(3)、实验室制Cl2用装置③吸收尾气,集气瓶中可放入溶液,尾气应从通入(填a、b)。三、推断题
-
22. A~J是常见的化学物质,转化关系如下图所示。A是生活中的一种调味剂,I是一种用途广泛的金属,常温下C、D、E、F、J皆为气体, H由两种元素构成,摩尔质量为41 g·mol-1。
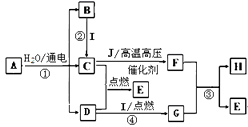 (1)、I的化学式为 , H的化学式为。(2)、写出反应①②③④的化学方程式
(1)、I的化学式为 , H的化学式为。(2)、写出反应①②③④的化学方程式①;②; ③; ④。
四、综合题
-
23. 氧化还原反应原理在生产生活和科学研究中应用广泛。(1)、下列表述中没有氧化还原反应发生的是。
a.滴水成冰 b.蜡炬成灰 c.百炼成钢
(2)、NH3和Cl2反应的方程式为: NH3+ Cl2—N2+ HCl①该反应中被氧化的元素是(填元素名称),氧化剂是(填化学式)。
②配平该方程式:NH3 + Cl2 — N2 + HCl
③工业生产中常用喷洒氨水的方法来检查是否有Cl2泄漏,若Cl2有泄漏,可以观察到的现象是 , 产生该现象的反应方程式为。
(3)、“地康法”制氯气的反应原理图示如下: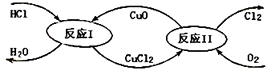
①反应I的化学方程式为。
②反应II属于反应。(填四种基本反应类型之一)。
③若要制得标准状况下氯气11.2L,则整个反应中转移电子的物质的量为。
24. 铁红(主要成分为Fe2O3)是一种用途广泛的颜料,用废铁屑制备铁红的流程如下: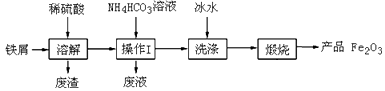 (1)、操作Ⅰ的名称是。(2)、检验FeCO3沉淀是否洗净的实验方法是。(3)、加入NH4HCO3溶液的反应除了生成FeCO3沉淀,还会生成一种气体,生成气体的离子方程式为。(4)、在空气中煅烧FeCO3的化学方程式是 , 若煅烧不充分,产品Fe2O3中会有FeO,为了避免产品中有FeO,可以采取的措施是。(5)、称取3.0 g 产品,用稀硫酸溶解,逐滴加入0.10 mol·L-1 KMnO4溶液20.00 mL,二者恰好反应完全。若此产品中只含有FeO、Fe2O3 , 求算产品中Fe2O3的质量分数,写出计算过程。
(1)、操作Ⅰ的名称是。(2)、检验FeCO3沉淀是否洗净的实验方法是。(3)、加入NH4HCO3溶液的反应除了生成FeCO3沉淀,还会生成一种气体,生成气体的离子方程式为。(4)、在空气中煅烧FeCO3的化学方程式是 , 若煅烧不充分,产品Fe2O3中会有FeO,为了避免产品中有FeO,可以采取的措施是。(5)、称取3.0 g 产品,用稀硫酸溶解,逐滴加入0.10 mol·L-1 KMnO4溶液20.00 mL,二者恰好反应完全。若此产品中只含有FeO、Fe2O3 , 求算产品中Fe2O3的质量分数,写出计算过程。(已知:10FeSO4+2KMnO4+8H2SO4=5Fe2(SO4)3+2MnSO4+K2SO4+8H2O)
-
-