江苏省宿迁市2017—2018学年度高二上学期化学期末考试试卷
试卷更新日期:2018-04-03 类型:期末考试
一、单选题
-
1. 1920年参与建设亚洲第一座纯碱厂——永利制碱厂,为我国纯碱工业发展做出杰出贡献的化学家是( )A、屠呦呦 B、侯德榜 C、张青莲 D、徐光宪2. 亚硝酸钠(NaNO2)可作为建筑工业的防冻剂,它属于( )A、酸 B、碱 C、盐 D、氧化物3. 中国科学家首次实现了两个异核原子的量子纠缠,该实验中用到了 ,下列关于 的说法正确的是( )A、质子数为87 B、核外电子数为37 C、中子数为37 D、质量数为504. 下列过程为物理变化的是( )A、氨气液化 B、粮食酿酒 C、金属锈蚀 D、石油裂化5. 下列反应能量变化与右图一致的是( )
 A、金属钠与水的反应 B、盐酸与氢氧化钠的反应 C、铝与氧化铁的铝热反应 D、电解水制H2和O26. 化学与生活密切相关。下列常见物质的俗名与化学式对应正确的是( )A、小苏打— NaHCO3 B、铁红— Fe3O4 C、熟石灰— CaO D、明矾— CuSO4·5H2O7. 下列气体可用如图所示方法收集的是( )
A、金属钠与水的反应 B、盐酸与氢氧化钠的反应 C、铝与氧化铁的铝热反应 D、电解水制H2和O26. 化学与生活密切相关。下列常见物质的俗名与化学式对应正确的是( )A、小苏打— NaHCO3 B、铁红— Fe3O4 C、熟石灰— CaO D、明矾— CuSO4·5H2O7. 下列气体可用如图所示方法收集的是( ) A、NO B、SO2 C、Cl2 D、H28. 下列化学用语表示正确的是( )A、氨气分子的电子式:
A、NO B、SO2 C、Cl2 D、H28. 下列化学用语表示正确的是( )A、氨气分子的电子式: B、乙酸分子的结构式:
B、乙酸分子的结构式:  C、Mg的原子结构示意图:
C、Mg的原子结构示意图:  D、硫酸铁的电离方程式:Fe2(SO4)3=2Fe2++3SO
9. 下列物质中含有离子键的是( )A、Cl2 B、Na2O2 C、CO 2 D、NH310. 下列说法正确的是( )A、常温常压下,1mol CH4的体积是22.4L B、1molFe在氯气中完全燃烧失去电子数为2NA C、用激光笔照射可鉴别Fe(OH)3胶体和FeCl3溶液 D、用焰色反应可鉴别NaCl和Na2CO311. 已知某溶液中存在H+、Ba2+、Cl-三种离子,其中还可能大量存在的离子是( )
D、硫酸铁的电离方程式:Fe2(SO4)3=2Fe2++3SO
9. 下列物质中含有离子键的是( )A、Cl2 B、Na2O2 C、CO 2 D、NH310. 下列说法正确的是( )A、常温常压下,1mol CH4的体积是22.4L B、1molFe在氯气中完全燃烧失去电子数为2NA C、用激光笔照射可鉴别Fe(OH)3胶体和FeCl3溶液 D、用焰色反应可鉴别NaCl和Na2CO311. 已知某溶液中存在H+、Ba2+、Cl-三种离子,其中还可能大量存在的离子是( )
A、NO3- B、CO32- C、SO42- D、Ag+12. 工业上常用浓氨水检查氯气管道是否泄漏,发生反应为:8NH3 + 3Cl2= N2 + 6NH4Cl,该反应属于( )A、化合反应 B、分解反应 C、置换反应 D、复分解反应13. 下列关于甲烷、乙烯和苯的说法正确的是( )A、乙烯和苯均能在空气中燃烧 B、甲烷和乙烯都能使溴水褪色 C、甲烷和乙烯互为同分异构体 D、乙烯和苯分子中均含碳碳双键14. 下列离子方程式正确的是( )A、稀醋酸与碳酸钠反应:CO +2H+ = CO2↑+H2O B、FeCl2溶液中通入Cl2:Fe2+ + Cl2 = Fe3+ + 2Cl― C、铜片与稀HNO3反应:Cu+2H+ = Cu2+ +H2↑ D、用NaOH溶液吸收多余Cl2:Cl2+2OH-= Cl-+ClO-+H2O15. 下列实验操作中,不能用于物质分离的是( )A、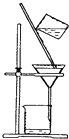 B、
B、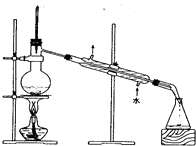 C、
C、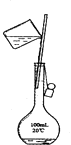 D、
D、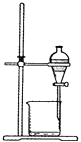 16. 疏松的糕点、饼干、面包等在制作过程中都使用了疏松剂。疏松剂受热分解,产生的气体使食品酥脆、松软。下列物质可作为食品制作过程中使用的疏松剂的是( )
16. 疏松的糕点、饼干、面包等在制作过程中都使用了疏松剂。疏松剂受热分解,产生的气体使食品酥脆、松软。下列物质可作为食品制作过程中使用的疏松剂的是( )
A、NaCl B、Na2CO3 C、NaHCO3 D、NaOH17. 二氧化氯是一种安全、高效的消毒剂,实验室制取二氧化氯的化学方程式如下:2NaClO3 + Na2SO3 + H2SO4 2ClO2↑+ 2Na2SO4 + H2O。下列有关该反应说法正确的是( )
A、NaClO3是还原剂 B、Na2SO3被氧化 C、NaClO3失去电子 D、H2SO4发生还原反应18. 下列有关离子检验的说法正确的是( )A、加入稀盐酸产生无色气体,气体能使澄清石灰水变浑浊,原溶液中一定含有CO32- B、加入稀盐酸无明显现象,再加入硝酸银溶液产生白色沉淀,原溶液中一定含有Cl- C、加入BaCl2溶液产生白色沉淀,再加入稀盐酸沉淀不溶解,原溶液中一定含有SO42- D、加入KSCN溶液,呈现血红色,原溶液中一定含有Fe3+19. 一定条件下将0.2mol N2和 0.3mol H2置于密闭容器中发生如下反应: 。下列关于该反应说法正确的是( )A、充分反应后H2无剩余 B、升高温度使反应速率增大 C、增大压强使反应速率减小 D、使用催化剂对反应速率没有影响20. 一种用于驱动潜艇的液氨﹣液氧燃料电池原理示意如图,下列有关该电池说法错误的是( ) A、电极a为电池负极 B、电极b上发生还原反应 C、该装置将化学能转化为电能 D、电子由b极经外电路流向a极21. 下列属于取代反应的是( )A、
A、电极a为电池负极 B、电极b上发生还原反应 C、该装置将化学能转化为电能 D、电子由b极经外电路流向a极21. 下列属于取代反应的是( )A、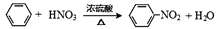 B、CH2=CH2+HCl CH3CH2Cl
C、CH4 +2O2 CO2+2H2O
D、2CH3CH2OH+O2 2CH3CHO+2H2O
22. X、Y、Z、W是短周期主族元素,它们的原子序数依次增大。X原子最外层电子数是次外层的2倍,Y是地壳中含量最多的元素,Y原子最外层电子数是Z原子最外层电子数的2倍, W与Y同主族。下列说法正确的是( )
B、CH2=CH2+HCl CH3CH2Cl
C、CH4 +2O2 CO2+2H2O
D、2CH3CH2OH+O2 2CH3CHO+2H2O
22. X、Y、Z、W是短周期主族元素,它们的原子序数依次增大。X原子最外层电子数是次外层的2倍,Y是地壳中含量最多的元素,Y原子最外层电子数是Z原子最外层电子数的2倍, W与Y同主族。下列说法正确的是( )
A、X形成的单质只有一种 B、原子半径:r(W)>r(Z)>r(Y) >r(X ) C、常温下,Z单质可溶于W的最高价氧化物的水化物的浓溶液中 D、Y简单气态氢化物的热稳定性比W的强23. 铁、铜混合粉末17.6 g加入到800mL 1.0mol/L的 FeCl3溶液中,充分反应后,所得溶液中Fe2+和Cu2+物质的量浓度之比为8∶1。下列有关说法正确的是( )
A、混合粉末中铁与铜的物质的量之比是1∶2 B、反应后的溶液最多还可以溶解铁粉5.6g C、反应后所得溶液中c(Fe2+)=1.0mol/L (假设反应前后溶液体积无变化) D、向反应后的溶液中加入2.0 mol/L NaOH溶液至金属离子恰好全部沉淀时,需加入NaOH溶液的体积是1.6 L二、综合题
-
24.(1)、2017年,宿迁市成功创建为全国文明卫生城市,城市生态环境明显改善。
①下列做法不利于改善空气质量的是。
a.工厂通过静电除尘减少悬浮颗粒物排放
b.以新能源公交车代替燃油公交车
c.夜间排放工业废气
② 公共场所安装直饮水设备,方便市民饮用。直饮水需要经过活性炭处理、超滤膜过滤、紫外灯照射等处理过程。其中活性炭作为。
a. 混凝剂 b. 吸附剂 c.杀菌、消毒剂
③ 宿迁40余处“落叶景观带”成为扮靓城市的秋冬美景,为保护落叶景观带设置的“严禁烟火”标志是。

a b c
(2)、红薯含有丰富的淀粉、膳食纤维、胡萝卜素、维生素A、B、C、E以及钾、铁、钙等多种营养成分,是一种营养均衡的保健食品。① 红薯中含有的可有效改善牙龈出血。
a.维生素A b.维生素B c.维生素C
② 以上成分中,(填元素符号)为人体必需的微量元素。
③ 红薯中含有丰富的淀粉,其在人体内完全水解的最终产物是(填化学式)。实验室检验该水解产物所用的试剂是。
④ 红薯不宜过多食用,否则会产生较多胃酸。双羟基铝碳酸钠[NaAl(OH)2CO3]是一种常用的抗酸药,它和胃酸反应的化学方程式为:。
(3)、2017年,世界最长的跨海大桥——港珠澳跨海大桥正式通车。建造大桥使用了大量钢材、水泥、玻璃、光导纤维、橡胶等材料。
① 工业上生产水泥、玻璃都用到的原料是。
② 深埋在海水中的钢管桩易发生腐蚀,下列保护钢管桩的措施不合理的是。
a.使用抗腐蚀性强的合金钢
b.在钢材表面喷涂防腐涂料
c.钢管桩附着铜以增强抗腐蚀性
③ 港珠澳大桥工程使用了大量密封橡胶衬垫。为使橡胶性能更好,天然橡胶需经过处理以增强其机械性能。
④ 光导纤维是由高纯度SiO2于2000℃下拉制而成,工业上常用SiCl4与O2在高温条件下通过置换反应制得SiO2 , 该反应的化学方程式为:。
25.(1)、根据分子中所含官能团可预测有机化合物的性质。① 下列化合物中能发生消去反应的是(填字母)。
a.CH3OH b.CH3CH2Cl c.HC≡CH
② 下列化合物中,常温下能被空气氧化的是(填字母)。

③ 下列化合物中,能发生水解反应的是(填字母)。
a.H2C=CH2 b.CH3COOCH2CH3 c.CH3CH2OH
(2)、甲苯( )是一种重要的有机化工原料。
)是一种重要的有机化工原料。① 甲苯分子中一定共平面的碳原子有个。
② 甲苯苯环上的一溴代物有种,请写出其中一种的名称:。
③ 除去甲苯中混有的少量苯酚,可选用的试剂是 , 写出该反应的化学方程式:。
(3)、化合物C是一种医药中间体,可通过下列方法合成:
① A中含氧官能团的名称为和。
② B的结构简式为。
③ B→C的反应类型为。
④ C的同分异构体D能发生银镜反应,能与FeCl3溶液发生显色反应。且1 mol D最多能与2 mol NaOH反应。D分子中有4种不同化学环境的氢,请写出D的一种结构简式。
26. 碳酸锰(MnCO3)是一种高性能磁性材料。以软锰矿粉(主要含MnO2 , 还含有少量的Fe2O3、Al2O3等杂质)为原料制取MnCO3的流程如下:
已知:“沉锰”反应为:Mn2+ + 2HCO = MnCO3↓+ H2O + CO2↑
(1)、“酸浸”时发生的主要反应为:2Fe2+ + MnO2+ 4H+ =2Fe3+ + Mn2+ + 2H2O。除此以外,还发生的反应离子方程式为。(任写一个)(2)、“沉锰”工序中,实验测得MnCO3的产率与溶液pH、反应时间t的关系如图所示。反应要控制pH在7左右的理由是。(答两点) (3)、“过滤Ⅱ”所得滤液中溶质的主要成分是。(4)、为测定某软锰矿中二氧化锰的质量分数,准确称量1.800g软锰矿样品,加入4.020 g草酸钠(Na2C2O4)固体,再加入足量的稀硫酸并加热(杂质不参加反应),充分反应后冷却,过量的Na2C2O4用0.2000 mol/L高锰酸钾溶液进行滴定,当滴入30.00mL溶液时恰好完全反应。已知高锰酸钾、二氧化锰在酸性条件下均能将草酸钠(Na2C2O4)氧化:MnO2 + C2O + 4H+ Mn2+ + 2CO2↑+ 2H2O,MnO4-+ C2O + H+ - Mn2+ + CO2↑+ H2O (未配平)。求该软锰矿中二氧化锰的质量分数(写出计算过程)。
(3)、“过滤Ⅱ”所得滤液中溶质的主要成分是。(4)、为测定某软锰矿中二氧化锰的质量分数,准确称量1.800g软锰矿样品,加入4.020 g草酸钠(Na2C2O4)固体,再加入足量的稀硫酸并加热(杂质不参加反应),充分反应后冷却,过量的Na2C2O4用0.2000 mol/L高锰酸钾溶液进行滴定,当滴入30.00mL溶液时恰好完全反应。已知高锰酸钾、二氧化锰在酸性条件下均能将草酸钠(Na2C2O4)氧化:MnO2 + C2O + 4H+ Mn2+ + 2CO2↑+ 2H2O,MnO4-+ C2O + H+ - Mn2+ + CO2↑+ H2O (未配平)。求该软锰矿中二氧化锰的质量分数(写出计算过程)。三、推断题
-
27. 有关物质的转化关系如下图所示(部分物质与条件已略去)。A的摩尔质量为80g/mol, B、D、H、J均为气体,B能使湿润的红色石蕊试液变蓝,D在空气中含量最多,H是一种无色、刺激性气味气体,C是一种紫红色金属单质, I是一种淡黄色固体。E是最常见的一种无色液体。
 (1)、A的化学式为。(2)、固体K的电子式为。(3)、反应②的化学方程式:。(4)、反应③的离子方程式:。
(1)、A的化学式为。(2)、固体K的电子式为。(3)、反应②的化学方程式:。(4)、反应③的离子方程式:。