粤教版化学九年级下册 8.4常见的盐 同步测试
试卷更新日期:2018-03-30 类型:同步测试
一、单选题
-
1. 下列物质的俗名与化学式相符合的是( )A、纯碱NaOH B、酒精C2H5OH C、生石灰Ca(OH)2 D、小苏打Na2CO32. 某同学对化学知识的归纳正确的是( )A、pH>7的溶液一定是碱的溶液 B、同种元素组成的物质一定是单质 C、生成盐和水的反应一定是复分解反应 D、能分解生成氧气的物质一定含有氧元素3. 食醋、纯碱、食盐均为家庭厨房中常用的物质,利用这些物质,不能完成的实验是( )A、除去热水瓶中的水垢 B、鉴别氯化钙和硝酸钙 C、检验贝壳能否溶于酸 D、检验久置的烧碱是否变质4. 下列关于物质用途的叙述不正确的是( )
A、用纯碱除去面团发酵时生成的酸,并使馒头变得疏松多 B、农业上用熟石灰来改良酸性土壤 C、建筑上常用大理石来装饰 D、因为化肥和农药能使农作物增产,大量使用它也有益无害5. 下列溶液混合后,不能发生复分解反应的一组是( )
A、HCl和NaOH B、Na2CO3和H2SO4 C、KNO3和NaCl D、NaOH和FeCl36. 在下列各组物质中,每组的3种物质两两之间都能发生化学反应的是( )①Cu、稀硫酸、CuO②稀盐酸、Ca(OH)2溶液、Na2CO3溶液③C、CO、Fe2O3 .
A、① B、② C、①③ D、②③7. 下列对实验过程的评价正确的是( )A、某固体中加稀盐酸产生无色气体,证明该固体中一定含有CO32﹣; B、某溶液中滴加BaCl2溶液,生成不溶于稀硝酸的白色沉淀,该溶液中一定含有SO42﹣; C、某无色溶液中滴加无色酚酞试液,溶液变成红色,该溶液不一定是碱; D、某溶液中加入AgNO3溶液有白色沉淀生成,该溶液中一定有Cl﹣8. 只用水做试剂,不能将组内固体物质鉴别出来的一组是( )A、氯化钾、硫酸钾 B、硫酸铜、硫酸钠 C、碳酸钙、碳酸钠 D、硝酸铵、氢氧化钠9. 下列各组物质投入水中.搅拌后能得到无色、澄清溶液的是( )A、KNO3、HCl、CuCl2 B、Ba(OH)2、BaCl2、、Na2SO4 C、Na2CO3、NaCl、Ca(OH)2 D、NaOH、KCl、H2SO410. 常温下,有反应:M+N→盐+水,其中M、N的类别不可能是( )A、酸、碱 B、单质、氧化物 C、氧化物、酸 D、氧化物、碱11. 向烧杯中逐滴加入x溶液至过量(图甲),生成沉淀或气体的质量与加入x溶液的质量关系符合图乙的是( )
烧杯中的物质 x溶液 A 镁铝合金 稀盐酸 B 稀硫酸和稀盐酸 氯化钡溶液 C 氯化钠和碳酸氢钠溶液 稀盐酸 D 稀盐酸和硫酸铜溶液 氢氧化钠溶液 A、A B、B C、C D、D12. 如图表示向一定量CaCl2和盐酸的混合溶液中滴加Na2CO3溶液的变化过程,x表示Na2CO3溶液的质量,则y可能表示( )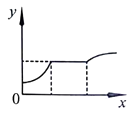 A、气体的体积 B、沉淀的质量 C、NaCl的质量 D、混合溶液的pH
A、气体的体积 B、沉淀的质量 C、NaCl的质量 D、混合溶液的pH二、填空题
-
13. 现有甲、乙两组溶液,甲:H2SO4、K2CO3、Fe(NO3)2乙:BaCl2、HCl、Ca(OH)2,甲组中只有可以与乙组所有的溶液反应,乙组中只有可以与甲组的所有物质反应.
14. 长期存放石灰水的试剂瓶内壁有一层白色固体,请分析这层白色固体产生的原因(用化学方程式表示);用完石灰水后,怎样除去壁上的白色固体?(用化学方程式表示)。三、实验探究题
-
15. 某化学兴趣小组为探究复分解反应能否发生,进行了如下实验:
实验编号
①
②
③
物质
NaOH溶液
Na2CO3溶液
BaCl2溶液
加稀硫酸后的现象
无明显现象
白色沉淀
(1)、实验②中的现象是 .(2)、小杨同学认为实验①不反应,小康同学不同意小杨同学的观点,认为无明显现象并不代表没有发生反应.经小组讨论,设计如下实验来探究稀硫酸与NaOH溶液能否发生反应.
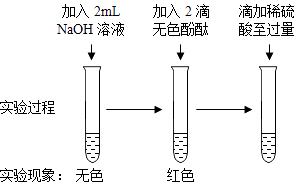
观察到上述实验试管中的现象(选填“红色消失”或“红色不消失”),说明稀硫酸与NaOH溶液发生了反应,该反应的化学方程式为 .
(3)、反应后,同学们将所有废液倒入同一烧杯中,静置,烧杯中有白色沉淀,溶液呈无色,该无色溶液中一定含有的溶质(除酚酞外)是(填化学式)四、综合题
-
16. 选择下列物质的序号填空
①小苏打 ②熟石灰 ③石灰石 ④苛性钠固体 ⑤稀盐酸
(1)、能用于改良酸性土壤的是(2)、胃里含有的能帮助消化的物质是(3)、是发酵粉的主要成分,医疗上可用于胃酸过多的是(4)、具有吸水性,通常可用于某些气体的干燥剂的是(5)、通常用于建筑材料的是17. 现有一包固体粉末,可能含有Na2CO3、Na2SO4、BaCl2、Ba(OH)2、Cu(NO3)2中的一种或几种.现做如下实验:(1)、取少量固体溶于水,过滤得白色沉淀A和无色滤液B,则原固体中一定不含 .(2)、取白色沉淀A,滴加过量稀HCl,固体不溶解,则原固体中一定不含 , 一定含有 .(3)、向无色滤液B中通入CO2 , 产生白色沉淀,则原固体中(选填“一定”或“不一定”,下同)含有Ba(OH)2 , 含有BaCl2 .18. 食盐是一种重要的化工原料,请回答下列问题。
(1)、请完善实验室除去粗盐中泥沙等难容性杂质的实验步骤。
①操作Ⅰ所用的玻璃仪器有:烧杯、玻璃棒和。
②蒸发过程中,待 时,停止加热,利用余热将滤液蒸干。
(2)、由于粗盐中含有少量MgCl2、CaCl2、Na2SO4等杂质,不能满足化工生产的要求,因此必须将粗盐进行精制,流程如图: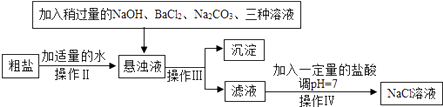
①加入稍过量的Na2CO3溶液除了能除去粗盐中的CaCl2外,它还有一个作用是(用化学方程式表示)。
②通过操作Ⅲ所得滤液中的溶质有(用化学式表示)。
(3)、若有溶质质量分数为10%的氯化钠不饱和溶液100kg,要将其变成20℃时氯化钠的饱和溶液,以满足化工生产的需要,可采用的最简便方法是 。(已知:20℃时氯化钠的溶解度为36g。)五、推断题
-
19.
图中的A--H是初中化学常见的化合物,其中B是氧化物,白色固体F易溶于水并放出大量的热,G、H是配置农药波尔多液的原料。“—”表示相互能反应,“→”表示物质间存在转化关系;部分反应物、生成物或反应条件已略去。
 (1)、F的化学式是 ,
(1)、F的化学式是 ,H的另一种常见用途是。
(2)、G和H反应的化学方程式 ,该反应的基本类型是。
(3)、若A、B、E、F是不同类别的化合物,则E和F反应的化学方程式。六、计算题
-
20. 测定某Na2CO3样品(混有KCl)中Na2CO3的质量分数,甲、乙两同学分别设计了以下方案:(1)、甲同学称取样品11.8 g,于烧杯中加水溶解后向其中加入过量的16%的CaCl2溶液,充分反应后将生成的沉淀过滤、洗涤、干燥,称其质量为1.00 g,试通过计算确定样品中Na2CO3的质量分数ω(Na2CO3)。(用百分数表示,结果保留1位小数)(2)、乙同学同样取样品11.8g,于烧杯中加水溶解后向其中加入一定量10%的盐酸溶液,充分反应,通过测定生成的的CO2的质量来确定Na2CO3的质量分数。试计算反应到少需要该盐酸溶液多少g?
-
-