河北省承德市联校2017-2018学年高二上学期化学期末考试试卷
试卷更新日期:2018-03-30 类型:期末考试
一、单选题
-
1. 能源与我们日常生活密切相关,下列有关能源的叙述中不正确的是( )
A、化石能源是不可再生的能源 B、发展太阳能有助于减缓温室效应 C、使用乙醇汽油可以减少汽车尾气排放造成的大气污染 D、人类利用的能源都是通过化学反应获得的2. 下列生产生活中需要增大化学反应速率的是( )A、铁锹生锈 B、牛奶变质
B、牛奶变质  C、塑料老化
C、塑料老化  D、高炉炼铁
D、高炉炼铁  3. 已知T℃时,CaCO3(s)=CaO(s)+CO2(g) △H=+177.70kJ·mol-1 , 则每生成28gCaO(s)时,吸收的热量为( )
3. 已知T℃时,CaCO3(s)=CaO(s)+CO2(g) △H=+177.70kJ·mol-1 , 则每生成28gCaO(s)时,吸收的热量为( )
A、44.43KJ B、88.85KJ C、133.28KJ D、177.70kJ4. 下列有关化学用语表示不正确的是( )A、乙烯的分子式:C2H4 B、甲烷分子的比例模型: C、乙醇的结构式:CH3CH2OH
D、环己烷的实验式:CH2
5. 下列属于水解的离子方程式且书写正确的是( )A、HCO3-+H2O H3O++CO32- B、CH3COO-+H2O CH3COOH+OH- C、SO32-+2H2O H2SO3+2OH- D、Fe3++3H2O Fe(OH)3↓+3H+6. 在2L的密闭容器中,发生以下反应:2A(g)+B(g) 2C(g)+D(g)。若最初加入的A和B都是3mol,在前10sA的化学反应速率为0.12mol·L-1·s-1 , 则10s时,容器中B的物质的量是( )A、0.6mol B、1.2mol C、1.8mol D、2.4mol7. 下列事实不能用电化学理论解释的是( )A、轮船水线下船壳上装有一定数量的锌块 B、银质奖章久置后表面变暗 C、镀锌铁比镀锡铁耐用 D、钢铁在潮湿空气中比在干燥空气中腐蚀得快8. 下列实验装置(夹持装置略去)选择正确且能达到相应实验目的的是( )A、测定中和热
C、乙醇的结构式:CH3CH2OH
D、环己烷的实验式:CH2
5. 下列属于水解的离子方程式且书写正确的是( )A、HCO3-+H2O H3O++CO32- B、CH3COO-+H2O CH3COOH+OH- C、SO32-+2H2O H2SO3+2OH- D、Fe3++3H2O Fe(OH)3↓+3H+6. 在2L的密闭容器中,发生以下反应:2A(g)+B(g) 2C(g)+D(g)。若最初加入的A和B都是3mol,在前10sA的化学反应速率为0.12mol·L-1·s-1 , 则10s时,容器中B的物质的量是( )A、0.6mol B、1.2mol C、1.8mol D、2.4mol7. 下列事实不能用电化学理论解释的是( )A、轮船水线下船壳上装有一定数量的锌块 B、银质奖章久置后表面变暗 C、镀锌铁比镀锡铁耐用 D、钢铁在潮湿空气中比在干燥空气中腐蚀得快8. 下列实验装置(夹持装置略去)选择正确且能达到相应实验目的的是( )A、测定中和热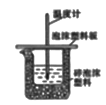 B、测定反应速率
B、测定反应速率 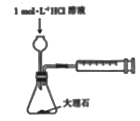 C、实现化学能转化为电能
C、实现化学能转化为电能 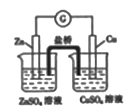 D、测定食醋浓度
D、测定食醋浓度 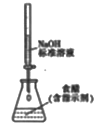 9. 在一恒容密闭烧瓶中,25℃时存在平衡:2NO2(g) N2O4(g) △H<0。将烧瓶置于100℃的水中,则下列物理量中不会改变的是( )
9. 在一恒容密闭烧瓶中,25℃时存在平衡:2NO2(g) N2O4(g) △H<0。将烧瓶置于100℃的水中,则下列物理量中不会改变的是( )
A、颜色 B、密度 C、N2O4的浓度 D、压强10. 下列装置中Fe片腐蚀最慢的是( )A、海水 B、海水
B、海水 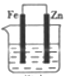 C、海水
C、海水 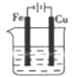 D、海水
D、海水 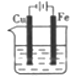 11. 由水电离产生的c(H+)为1×10-12mol/L的溶液中,能大量共存的离子组是( )
11. 由水电离产生的c(H+)为1×10-12mol/L的溶液中,能大量共存的离子组是( )
A、Na+、Cl-、NO3-、SO42- B、K+、Fe3+、I-、SO42- C、K+、Cl-、NH4+、S2- D、Na+、Ca2+、Cl-、HCO3-12. 对于反应:H2(g)+I2(g) 2HI(g) △H<0,当该反应达到平衡时,下列说法正确的是( )
A、减小容器体积,平衡向右移动 B、加入催化剂,HI的产率增大 C、增大c(I2),H2的转化率增大 D、升高温度,I2的转化率增大13. 由U形管、铁棒、碳棒和CuCl2溶液组成如图所示装置,下列说法不正确的是( )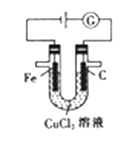 A、铁棒为阴极,碳棒为阳极 B、阴极的电极反应式为Cu2++2e-=Cu C、转移0.2mol电子时,阳极生成2.24L气体 D、若将碳棒换成铜棒,可实现在铁棒上镀铜14. 醋酸中存在如下电离平衡:CH3COOH CH3COO-+H+ , 下列措施可以使c(CH3COOH)/c(H+)的值减小 的是( )A、加入水 B、加入少量氢氧化钠固体 C、加入少量冰醋酸 D、加入少量醋酸钠固体15. 反应A(g)+2B(g)=C(g)的能量变化与反应进程关系如图所示,下列说法不正确的是( )
A、铁棒为阴极,碳棒为阳极 B、阴极的电极反应式为Cu2++2e-=Cu C、转移0.2mol电子时,阳极生成2.24L气体 D、若将碳棒换成铜棒,可实现在铁棒上镀铜14. 醋酸中存在如下电离平衡:CH3COOH CH3COO-+H+ , 下列措施可以使c(CH3COOH)/c(H+)的值减小 的是( )A、加入水 B、加入少量氢氧化钠固体 C、加入少量冰醋酸 D、加入少量醋酸钠固体15. 反应A(g)+2B(g)=C(g)的能量变化与反应进程关系如图所示,下列说法不正确的是( )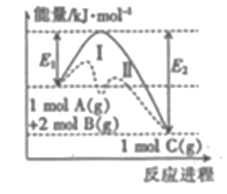 A、图中虚线表示加入了催化剂 B、图中虚线表示的反应I、反应II均为放热反应 C、加入催化剂,改变了反应历程 D、该反应的焓变△H=(E2-E1)kJ/mol16. 25℃时,几种弱酸的电离平衡常数如下表所示,下列说法正确的是( )
A、图中虚线表示加入了催化剂 B、图中虚线表示的反应I、反应II均为放热反应 C、加入催化剂,改变了反应历程 D、该反应的焓变△H=(E2-E1)kJ/mol16. 25℃时,几种弱酸的电离平衡常数如下表所示,下列说法正确的是( )化学式
HCOOH
H2CO3
HCN
电离平衡常数
K=1.8×10-4
K1=4.3×10-7
K2=5.6×10-11
K=4.9×10-10
A、H2CO3溶液和NaCN溶液反应的离子方程式为H2CO3+CN-=HCO3-+HCN B、HCOOH的电离平衡常数表达式为K= c(HCOOH)/[c(HCOO-)·c(H+)] C、Na2CO3溶液显碱性,NaHCO3溶液显酸性 D、酸性强弱顺序是HCOOH>HCN>H2CO317. 乙硼烷(B2H6)碱性燃料电池是一种新型电池,具有能量转化效率高、无污染等优点,其结构示意图如图所示。下列说法中不正确的是( )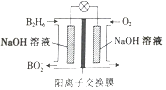 A、正极的电极反应式为O2+4e-+2H2O=4OH- B、电池工作时,Na+通过阳离子交换膜向右移动 C、转移6mol电子理论上消耗乙硼烷的质量为14g D、消耗1molB2H6时负极参与反应的n(OH-)为12mol18. 对于反应;2NO(g)+2CO(g) 2CO2(g)+N2(g) ΔH<0。若该反应在绝热恒容的密闭体系中进行,则下列示意图正确且能说明反应进行到t1时已达到平衡状态的是( )A、
A、正极的电极反应式为O2+4e-+2H2O=4OH- B、电池工作时,Na+通过阳离子交换膜向右移动 C、转移6mol电子理论上消耗乙硼烷的质量为14g D、消耗1molB2H6时负极参与反应的n(OH-)为12mol18. 对于反应;2NO(g)+2CO(g) 2CO2(g)+N2(g) ΔH<0。若该反应在绝热恒容的密闭体系中进行,则下列示意图正确且能说明反应进行到t1时已达到平衡状态的是( )A、 B、
B、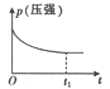 C、
C、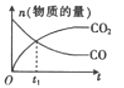 D、
D、 19. 下列实验现象与结论不一致的是( )
19. 下列实验现象与结论不一致的是( )选项
实验现象
实验操作
结论
A
等体积等浓度的HA 和HB两种酸分别与足量的锌反应,用排水法收集气体
HA放出氢气的反应速率更快
酸性:HB<HA
B
以铜、铁、浓硝酸构成原电池
铁表面有红棕色气泡产生
铜作原电池的负极
C
向25mL冷水和沸水中分别滴入5滴FeCl3 饱和溶液
前者为黄色,后者为红褐色
升高温度,Fe3+ 的水解程度增大
D
将固体CaSO4加入Na2CO3 饱和溶液中
一段时间后,检验固体主要成分为CaCO3
Ksp(CaSO4)3>Ksp(CaCO3)
A、A B、B C、C D、D20. 室温下向10mL0.1mol/LNaOH溶液中加入0.1mol/L的一元酸HA溶液,溶液pH的变化曲线如图所下列说法不正确的是( )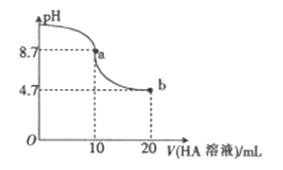 A、a点所示溶液中:c(A-)>c(Na+)>c(OH-)>c(H+) B、a点所示溶液中:c(Na+)=0.05mol/L C、pH=7时,c(Na+)=c(A-) D、b点所示溶液中:c(Na+)<c(A-)
A、a点所示溶液中:c(A-)>c(Na+)>c(OH-)>c(H+) B、a点所示溶液中:c(Na+)=0.05mol/L C、pH=7时,c(Na+)=c(A-) D、b点所示溶液中:c(Na+)<c(A-)二、填空题
-
21. 依据物质的分类标准可将一种物质归属多个类别。现有下列物质:
①
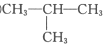 ②CH2=CH2 ③
②CH2=CH2 ③ 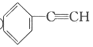 ④CH3CH2CH2CH3
④CH3CH2CH2CH3⑤
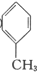 ⑥
⑥ 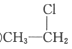 ⑦CH3CHO ⑧
⑦CH3CHO ⑧  (1)、⑥中的官能团名称为;⑦中的官能团名称为。(2)、属于烯烃的有(填序号,下同)。(3)、属于同分异构体的有。(4)、属于芳香烃的有。22. 工业上制硫酸的主要反应之一为2SO2(g)+O2(g) 2SO2(g),反应过程中能量的变化如图所示。
(1)、⑥中的官能团名称为;⑦中的官能团名称为。(2)、属于烯烃的有(填序号,下同)。(3)、属于同分异构体的有。(4)、属于芳香烃的有。22. 工业上制硫酸的主要反应之一为2SO2(g)+O2(g) 2SO2(g),反应过程中能量的变化如图所示。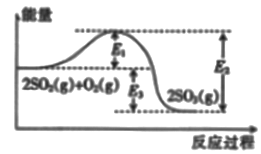 (1)、由图可知该反应的正反应为 (填“吸热”或“放热”) 反应。(2)、向反应体系中加入催化剂后,图中E1(填“增大”“或“减小”或“不变”,下同),E3。(3)、已知:2H2S(g)+O2(g)=2S(s)+2H2O(g) ΔH=-442.4kJ/mol
(1)、由图可知该反应的正反应为 (填“吸热”或“放热”) 反应。(2)、向反应体系中加入催化剂后,图中E1(填“增大”“或“减小”或“不变”,下同),E3。(3)、已知:2H2S(g)+O2(g)=2S(s)+2H2O(g) ΔH=-442.4kJ/molS(s)+O2(g)=SO2(g) ΔH=-297.0 kJ/mol 。
若H2S(g)与O2(g)反应产生SO2(g)和H2O(g),则消耗0.5mol H2S时,反应中转移的电子总数为(用NA 表示阿伏加德罗常数的数值),放出的热量为kJ。
23. 氨是重要的无机化工产品,合成氨工业对国民经济和社会发展具有重要的意义。其原理如下:N2(g)+3H2(g) 2NH3 (g) ΔH< 0。在恒温恒容密闭容器中进行合成氨反应,各组分浓度与时间的关系如图所示。 (1)、表示N2浓度变化的曲线是 (填字母),25 min 时c (NH3)=。(2)、0~25min内,用H2 浓度变化表示的化学反应速率是。(3)、此温度下,上述反应的平衡常数K 的数值为。(4)、若升高温度,则平衡向(填“正反应”或“逆反应”)方向移动;正反应速率 (填“增大”“减小”或“不变”,下同 ), 逆反应速率。24. 某二元酸(H2A)在水中的电离方程式是H2A=H++HA- , HA- H++A2-。(1)、Na2A溶液显(填“酸性”“中性”或“碱性”)。理由是(用离子方程式表示)。(2)、已知0.1mol/L的NaHA溶液的pH=2,则0.1mol/L的H2A溶液中c(H+ )(填“<”“>”或“=”)0.11mol/L。(3)、在0.1mol/L的Na2A溶液中,下列微粒浓度关系式不正确的是__(填字母)。A、c(A2- )+c(HA-)=0.1mol/L B、c(OH-)=c(H+) +c(HA-) C、c(Na+)+c(H+)=c(OH-)+c(HA-)+c(A2-) D、c(Na+)=2c(A2-)+2c(HA-)(4)、若向0.1mol/L的H2A溶液中加入等体积等浓度的NaOH溶液,则溶液中各离子浓度由大到小的顺序为。
(1)、表示N2浓度变化的曲线是 (填字母),25 min 时c (NH3)=。(2)、0~25min内,用H2 浓度变化表示的化学反应速率是。(3)、此温度下,上述反应的平衡常数K 的数值为。(4)、若升高温度,则平衡向(填“正反应”或“逆反应”)方向移动;正反应速率 (填“增大”“减小”或“不变”,下同 ), 逆反应速率。24. 某二元酸(H2A)在水中的电离方程式是H2A=H++HA- , HA- H++A2-。(1)、Na2A溶液显(填“酸性”“中性”或“碱性”)。理由是(用离子方程式表示)。(2)、已知0.1mol/L的NaHA溶液的pH=2,则0.1mol/L的H2A溶液中c(H+ )(填“<”“>”或“=”)0.11mol/L。(3)、在0.1mol/L的Na2A溶液中,下列微粒浓度关系式不正确的是__(填字母)。A、c(A2- )+c(HA-)=0.1mol/L B、c(OH-)=c(H+) +c(HA-) C、c(Na+)+c(H+)=c(OH-)+c(HA-)+c(A2-) D、c(Na+)=2c(A2-)+2c(HA-)(4)、若向0.1mol/L的H2A溶液中加入等体积等浓度的NaOH溶液,则溶液中各离子浓度由大到小的顺序为。三、解答题
-
25. 如图所示,A、B、C、D为石墨电极,E、F分别为短周期相邻两种活泼金属中的一种,且E能与NaOH溶液反应。按图示接通线路,反应一段时间。
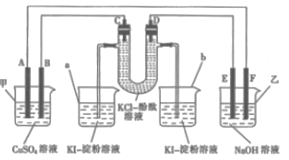 (1)、甲池是(填“原电池”或“电解池”,下同)装置;乙池是装置。(2)、C极为(填“阴极”或“阳极”)。(3)、烧杯中溶液会变蓝的是(填“a”或“b”)。(4)、C极上的电极反应式为。(5)、甲池中反应的化学方程式为。
(1)、甲池是(填“原电池”或“电解池”,下同)装置;乙池是装置。(2)、C极为(填“阴极”或“阳极”)。(3)、烧杯中溶液会变蓝的是(填“a”或“b”)。(4)、C极上的电极反应式为。(5)、甲池中反应的化学方程式为。