粤教版化学九年级下册 6.2 金属的化学性质 同步测试
试卷更新日期:2018-03-28 类型:同步测试
一、单选题
-
1. 下列关于金属的说法中,不正确的是( )A、铜有良好的导电性,常用于制作导线 B、所有的金属都能与稀盐酸反应 C、铁制品在干燥的空气中不易生锈 D、不锈钢具有较强的耐腐蚀性,可用于制作医疗器械2. 关于下列实验现象,描述错误的是( )A、光亮的铜丝放入稀硫酸中,溶液变为蓝色,产生大量气泡 B、镁条在空气中剧烈燃烧,发出耀眼的白光,生成白色固体 C、铁丝在氧气中剧烈燃烧,火星四射,生成黑色固体 D、氢气在空气中燃烧,产生淡蓝色火焰,放出大量的热3. 从混合物中分离与提纯X(括号内是杂质),不能用如图所示方案的是( )
 A、Ag(Fe) B、Cu(CuO) C、CaCO3(CaCl2) D、FeSO4(CuSO4)4. 某黑色固体粉末可能是Fe、FeO、CuO和C中的一种或几种.取黑色粉末,加入一定量的稀硫酸,待充分反应后过滤,得到滤液和滤渣,在滤液中插入一根洁净的铁丝.有关说法正确的是( )A、若滤液呈浅绿色,则原黑色固体粉末中一定有Fe B、若铁丝表面只有红色固体析出,则滤渣中一定无CuO C、若铁丝表面无明显现象,则滤渣中最多有四种物质 D、若铁丝表面只有气泡产生,则滤液中溶质一定有H2SO4和FeSO45. 如图为铜片A的系列变化,下列推断不正确的是( )
A、Ag(Fe) B、Cu(CuO) C、CaCO3(CaCl2) D、FeSO4(CuSO4)4. 某黑色固体粉末可能是Fe、FeO、CuO和C中的一种或几种.取黑色粉末,加入一定量的稀硫酸,待充分反应后过滤,得到滤液和滤渣,在滤液中插入一根洁净的铁丝.有关说法正确的是( )A、若滤液呈浅绿色,则原黑色固体粉末中一定有Fe B、若铁丝表面只有红色固体析出,则滤渣中一定无CuO C、若铁丝表面无明显现象,则滤渣中最多有四种物质 D、若铁丝表面只有气泡产生,则滤液中溶质一定有H2SO4和FeSO45. 如图为铜片A的系列变化,下列推断不正确的是( )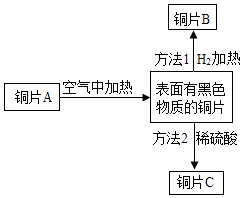 A、铜片表面上的黑色物质是CuO B、方法1发生的反应类型是置换反应 C、方法2中现象为铜片上的黑色物质逐渐溶解,溶液变为蓝色 D、若方法1,方法2均完全反应,则铜片A,B,C的质量相等6. 向一定量硝酸银和硝酸亚铁的混合溶液中加入锌粉,充分反应后所得溶液的质量与加入锌粉的质量关系如图所示.下列说法正确的是( )
A、铜片表面上的黑色物质是CuO B、方法1发生的反应类型是置换反应 C、方法2中现象为铜片上的黑色物质逐渐溶解,溶液变为蓝色 D、若方法1,方法2均完全反应,则铜片A,B,C的质量相等6. 向一定量硝酸银和硝酸亚铁的混合溶液中加入锌粉,充分反应后所得溶液的质量与加入锌粉的质量关系如图所示.下列说法正确的是( )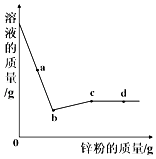 A、a点所得固体为银和铁 B、b点所得溶液中的溶质为硝酸银、硝酸亚铁和硝酸锌 C、c点所得溶液中的溶质为硝酸亚铁和硝酸锌 D、d点所得固体为银、铁和锌
A、a点所得固体为银和铁 B、b点所得溶液中的溶质为硝酸银、硝酸亚铁和硝酸锌 C、c点所得溶液中的溶质为硝酸亚铁和硝酸锌 D、d点所得固体为银、铁和锌二、填空题
-
7. 在做金属化学性质探究实验时:
①已知金属A和B能够发生如下反应:Zn+ACl2=ZnCl2+A B+ZnCl2=BCl2+Zn判断Zn、A、B三种 金属的活动性由强到弱依次是 .
②某同学不小心把实验后的铁钉和铜丝倒入含有稀硫酸的废液缸中,发现有气泡产生,用化学方程式解释产生气泡的原因 .
8.某学生用图示装置测定生铁中碳的含量(假定生铁中不含有其他杂质),试回答下列问题:

①A中的现象是 ,反应的化学方程式是: ;
②为了减少实验误差,A装置加入药品的方法是
③若氢气密度为ρg/L,称取生铁a g.完全反应后量筒里的水为b L,则此生铁中碳的质量分数的表达式为 .
④如果此生铁中混有少量锌,则测得结果 (填写“偏大”、“偏小”或“无影响”).
三、实验探究题
-
9. 填写实验报告。
【实验目的】探究铜、铝、银的金属活动性顺序。
【实验过程】
实验内容
实验现象
解释或化学方程式
⑴将一根用砂纸打磨干净的铝线浸入硫酸铜溶液中。
铝线表面有色物质生成,溶液颜色变浅。
用砂纸打磨铝线的目的是。
⑵将一根用砂纸打磨干净的铜线浸入溶液中。
铜线表面有银白色物质生成,溶液由无色变成蓝色。
化学方程式:。
【实验结论】铜、铝、银的金属活动性顺序由强到弱为。
四、综合题
-
10. 金属材料在人类的生产、生活中有着十分重要的作用.(1)、多种金属可以压成薄片,抽成细丝,说明金属具有性.(2)、实验室有打磨过的铝片、铁片和硫酸铜溶液.兴趣小组同学欲验证铝、铁和铜的活泼行顺序,进行如下操作:
①取少量硫酸铜溶液于试管A中,将铁片(足量)插入硫酸铜溶液中,充分反应后将铁片取出,观察到的实验现象是 .
②(请补充实验具体操作).
③取少量硫酸铜溶液于试管B中,将铝片插入硫酸铜溶液中,充分反应,写出该反应的化学方程式 .
结论:三种金属的活泼性由强到弱顺序是 .
(3)、金属腐蚀造成的损失巨大,对金属腐蚀的控制尤为重要.下列对金属的防护措施不合理的是(填序号).a、齿轮表面涂油 b、将钢材深埋保存
c、将钢刀浸泡在盐水中 d、车圈镀铬.
-