鲁教版九年级下学期化学同步测试 : 第九章 第二节 金属的化学性质
试卷更新日期:2018-03-27 类型:同步测试
一、单选题
-
1. 新买的铝锅、铝壶用来烧开水,凡是水浸到的地方都会变黑,这种现象说明该水中含有( )
A、钾元素 B、钠元素 C、钙元素 D、铁元素2. 下列金属中,活动性最弱的是 ( )A、铝 B、铜 C、镁 D、铁3. 为了更好地研究飞机事故的原因,每架飞机上都有黑匣子,用于记录出事时的数据。飞机的黑匣子内部保护存储数字信息的内存卡外壳是铝壳,环绕内存卡还有一铝薄层。有关铝的性质的说法中不正确的是( )
A、选择金属铝作外壳是因为铝的密度小,以减轻黑匣子的重量 B、这里的铝薄层可能是铝合金 C、铝表面致密的氧化物薄膜阻止铝进一步被氧化 D、铝在空气中不易被氧化4. 下列关于锌、铁、铜的说法错误的是( )A、均可以导电 B、均可以和氧气反应 C、均可以和稀盐酸反应 D、铁能与硫酸铜溶液的溶质发生置换反应5. 将一枚洁净的铁钉浸入稀硫酸中,下列叙述正确的是( )①铁钉表面产生气泡;
②液体由无色逐渐变为浅绿色;
③铁钉的质量减轻;
④液体的质量减轻.
A、②③ B、①②④ C、①②③ D、①②③④6. 能与无色硝酸银溶液反应,使溶液变为蓝色的金属是( )A、铝 B、铁 C、铜 D、银7. 下列有关铁的化学方程式中正确的是( )A、4Fe+3O2 2Fe2O3 B、Fe+H2SO4=FeSO4+H2↑ C、2Fe+6HCl=2FeCl3+3H2↑ D、2Fe+3CuSO4=3Cu+Fe2(SO4)38. 下列反应属于置换反应的是( )A、3NO2+H2O=2HNO3+NO B、2KMnO4 K2MnO4+MnO2+O2↑
C、C+H2O CO+H2
D、CO+CuO
K2MnO4+MnO2+O2↑
C、C+H2O CO+H2
D、CO+CuO  Cu+CO2
9. 如图,在杠杆的两端分别挂着质量相等的铜球和锌球,这时杠杆平衡。然后将两球分别浸没在稀硫酸和CuSO4溶液中片刻,下列说法中正确的是( )
Cu+CO2
9. 如图,在杠杆的两端分别挂着质量相等的铜球和锌球,这时杠杆平衡。然后将两球分别浸没在稀硫酸和CuSO4溶液中片刻,下列说法中正确的是( ) A、只有左边烧杯中溶液的质量增加 B、只有右边烧杯中溶液的质量增加 C、两边烧杯中溶液的质量都增加 D、去掉烧杯后,杠杆仍然保持平衡10. 常见金属活动性顺序表如下:
A、只有左边烧杯中溶液的质量增加 B、只有右边烧杯中溶液的质量增加 C、两边烧杯中溶液的质量都增加 D、去掉烧杯后,杠杆仍然保持平衡10. 常见金属活动性顺序表如下:
下列各组物质不能发生化学反应的是( )
A、汞与硝酸银溶液 B、铜与硝酸镁溶液 C、锌与硫酸亚铁溶液 D、铝与稀盐酸11. 要除去银粉中含有的少量铜粉,可加入下列试剂中的( )A、Hg(NO3)2溶液 B、AgNO3溶液 C、ZnSO4溶液 D、H2SO4溶液12. 根据金属活动性顺序分析,下列描述或判断正确的是( )A、金属钾能与硫酸锌溶液发生化学反应得到金属锌 B、在氧气中灼烧时,铁丝比铜丝反应剧烈 C、在常温下,铝比镁更容易与氧气发生化学反应 D、在常温下,金属铜与氯化银反应得到金属银13. 在天平两盘上的烧杯中,各放入质量相同的稀硫酸,调节天平至平衡。分别向两边烧杯中各加入5 g镁和5 g铁,镁和铁全部反应而消失后,天平的指针( )A、偏向加铁的一边 B、偏向加镁的一边 C、仍停留在原来的位置 D、无法确定14. 小思实验操作考试的题目是探究金属的化学性质,内容包括:铜在空气中灼烧、锌与稀硫酸反应、铝丝与硫酸铜溶液反应。如图是他实验操作考试中的部分情景。
 (1)、上图中有一处错误的操作,该操作是(填序号);(2)、操作A的现象是;(3)、他将铝丝插入到硫酸铜溶液中,未出现任何现象,其原因是。15. 下列各组物质不能发生反应的是( )A、镁与稀硫酸 B、锌与硫酸铜溶液 C、铝与硝酸银溶液 D、汞与氯化铜溶液16. 现有甲、乙、丙三种金属,分别与空气和氧气反应,现象如下表所示:
(1)、上图中有一处错误的操作,该操作是(填序号);(2)、操作A的现象是;(3)、他将铝丝插入到硫酸铜溶液中,未出现任何现象,其原因是。15. 下列各组物质不能发生反应的是( )A、镁与稀硫酸 B、锌与硫酸铜溶液 C、铝与硝酸银溶液 D、汞与氯化铜溶液16. 现有甲、乙、丙三种金属,分别与空气和氧气反应,现象如下表所示:甲
乙
丙
空气
剧烈燃烧
变黑
变黑
氧气
更剧烈燃烧
变黑
剧烈燃烧
据以上信息,这三种金属活动性由强到弱的顺序是( )
A、甲>丙>乙 B、甲>乙>丙 C、乙>丙>甲 D、丙>乙>甲17. 下列有关金属的说法正确的是( )
A、铝具有很好的抗腐蚀性能 B、铜能置换出酸中的氢 C、钢是纯净物 D、银能把铁从氯化亚铁溶液中置换出来18. 下列说法符合图中漫画情景的是( )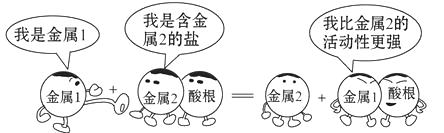 A、此反应可能是复分解反应 B、若金属1是锌,金属2可能是银 C、此反应可能是Cu+2AgCl=2Ag+CuCl2 D、比较铁和铜的活动性强弱可以用硫酸镁溶液19. 某合金6g与足量的稀硫酸充分反应后,如果生成0.2g氢气,该合金中的元素可能是( )
A、此反应可能是复分解反应 B、若金属1是锌,金属2可能是银 C、此反应可能是Cu+2AgCl=2Ag+CuCl2 D、比较铁和铜的活动性强弱可以用硫酸镁溶液19. 某合金6g与足量的稀硫酸充分反应后,如果生成0.2g氢气,该合金中的元素可能是( )
A、Zn和Fe B、Cu和Au C、Zn和Cu D、Mg和Al20. 把某稀硫酸分为等体积的两份,放入两个烧杯中,分别加入等质量的甲、乙两种金属,反应后金属都没有剩余。产生H2的质量随时间变化的趋势如图。下列说法正确的是( ) A、甲的活动性比乙强 B、甲的相对原子质量一定比乙小 C、反应消耗等质量的硫酸 D、反应消耗等质量的金属
A、甲的活动性比乙强 B、甲的相对原子质量一定比乙小 C、反应消耗等质量的硫酸 D、反应消耗等质量的金属二、填空题
-
21. 农业上配制波尔多液(CuSO4溶液)时,不用铁桶盛装,原因是(用化学方程式表示),该反应说明铁的活动性比铜(填“强”或“弱”);黄金是一种贵重金属,各种黄金首饰易于保存,具有收藏价值的主要原因是。
22. 观察一下我们的周围,就会发现金属的用途之广。 (1)、根据如图的应用实例,可知金属具有的物理性质有。(2)、在已经发现的一百余种元素中,金属元素的种类远比非金属元素的种类;工业上用赤铁矿作原料炼铁的化学方程式为。(3)、工人师傅切割铁板时,常用硫酸铜溶液在铁板上画线即可留下红色的印迹,此过程中发生反应的化学方程式为。23. 现有铜与另一种金属R(可能是银、镁、铁中的一种)的混合粉末。欲确定R的成分,请你一起完成:
(1)、根据如图的应用实例,可知金属具有的物理性质有。(2)、在已经发现的一百余种元素中,金属元素的种类远比非金属元素的种类;工业上用赤铁矿作原料炼铁的化学方程式为。(3)、工人师傅切割铁板时,常用硫酸铜溶液在铁板上画线即可留下红色的印迹,此过程中发生反应的化学方程式为。23. 现有铜与另一种金属R(可能是银、镁、铁中的一种)的混合粉末。欲确定R的成分,请你一起完成:
(1)、请将银、镁、铁三种金属的元素符号填写在下列金属活动性顺序表中的相应位置。 (2)、取少量的金属粉末于试管中,逐滴加入稀硫酸,有气泡产生,则R不可能是。(3)、待不再产生气泡时,再进行(填写一种实验操作方法),得到溶液和铜。然后往溶液中加入洁净的锌片,锌片表面有金属析出,则R是。(4)、写出金属R与稀硫酸反应的化学方程式。该反应的基本类型属于(填“化合”“分解”“置换”或“复分解”)反应。24. 早在西汉时期,我国就用铁与硫酸铜溶液反应制取铜,称为“湿法炼铜”。
(2)、取少量的金属粉末于试管中,逐滴加入稀硫酸,有气泡产生,则R不可能是。(3)、待不再产生气泡时,再进行(填写一种实验操作方法),得到溶液和铜。然后往溶液中加入洁净的锌片,锌片表面有金属析出,则R是。(4)、写出金属R与稀硫酸反应的化学方程式。该反应的基本类型属于(填“化合”“分解”“置换”或“复分解”)反应。24. 早在西汉时期,我国就用铁与硫酸铜溶液反应制取铜,称为“湿法炼铜”。
(1)、请写出“湿法炼铜”的化学方程式。(2)、若用该方法制得铜32 g,反应的铁的质量为g,若同时消耗了500 g硫酸铜溶液,则该硫酸铜溶液中硫酸铜的质量分数为%。25. 下图为某学习小组探究金属化学性质时所做的四个实验,仔细分析后回答下列问题: (1)、描述A中的实验现象。(2)、写出C中反应的化学方程式。(3)、要证明Cu、Fe、Ag的活动性顺序,至少要做的实验是(填序号)。(4)、开始反应后D中溶液逐渐变为黄色,原因是。26. 用质量相等的锌粉和铁粉,分别与溶质质量分数相同且等质量的稀盐酸充分发生反应,产生氢气的质量与时间的关系如图所示.
(1)、描述A中的实验现象。(2)、写出C中反应的化学方程式。(3)、要证明Cu、Fe、Ag的活动性顺序,至少要做的实验是(填序号)。(4)、开始反应后D中溶液逐渐变为黄色,原因是。26. 用质量相等的锌粉和铁粉,分别与溶质质量分数相同且等质量的稀盐酸充分发生反应,产生氢气的质量与时间的关系如图所示.
请回答下列问题:
(1)、表示锌粉与稀盐酸反应的曲线为(填“a”或“b”).(2)、对于a曲线表示的反应,(填名称)有剩余.27. 某兴趣小组的同学从实验室收集到一桶含有FeSO4、CuSO4的废液,他们想从中回收金属铜和硫酸亚铁晶体,设计了如下实验方案。结合实验方案回答下列问题: (1)、步骤①中,金属X是 , 该反应的化学方程式为;(2)、步骤②中,加入过量稀硫酸的目的是;(3)、从滤液中获得硫酸亚铁晶体采用的方法是。
(1)、步骤①中,金属X是 , 该反应的化学方程式为;(2)、步骤②中,加入过量稀硫酸的目的是;(3)、从滤液中获得硫酸亚铁晶体采用的方法是。三、简答题
-
28. 黄铜是铜、锌合金,它可用来制造机器、电器零件及日用品。为测定某黄铜样品中铜的质量分数,现取10 g该样品粉碎,加入到50 g稀硫酸中,恰好完全反应,测得剩余固体质量为3.5 g。计算:(1)、黄铜样品中铜的质量分数。(2)、稀硫酸中溶质的质量分数。(3)、由此得到启示是:在使用黄铜制品时应注意。(合理即可)
四、实验题
-
29. 金属材料被广泛的应用于我们的生活中,不仅是因为其物理性能优良,还与它们的化学性质密切相关。下面是小明同学设计测定金属铁、铜和镁的活动性的探究实验过程和实验记录,请你一起探究。
【实验目的】测定金属铁、铜和镁的活动性强弱
【所用试剂】稀硫酸、硝酸银溶液、光亮的薄铁片、薄铜片、薄镁片
【实验过程】步骤Ⅰ 将铁片、铜片、镁片分别在空气中点燃片刻,观察燃烧现象;
步骤Ⅱ 将铁片、铜片、镁片分别放入三只盛有溶质质量分数相同、体积相同的稀硫酸的试管中;
步骤Ⅲ 将铁片、铜片、镁片分别放入三只盛有溶质质量分数相同、体积相同的硝酸银溶液的试管中。
实验现象记录表
金属
空气
稀硫酸
硝酸银溶液
铁
-
铜
-
-
镁
【实验记录】用“”表示能观察到实验现象,用“-”表示观察不到实验现象(见表)。
(1)、通过步骤Ⅰ可以得出三种金属中镁的金属活动性最强,判断依据是。(2)、运用“控制变量法”设计实验方案是化学研究的重要方法。步骤Ⅱ和步骤Ⅲ中,需要控制的实验条件除了金属的体积、溶液的体积、溶质质量分数以外,还需要控制的条件是。写出镁和稀硫酸反应的化学方程式 , 此反应属于。(3)、【实验结论】金属铁、铜和镁的活动性由强到弱的顺序是 (用元素符号表示)。(4)、【反思交流】若利用上述试剂制取氢气,小明认为应该选择金属铁和稀硫酸反应,而不选择金属镁和稀硫酸反应,他的理由是 。
-