鲁教版九年级下学期化学同步测试 :第八单元测试题
试卷更新日期:2018-03-27 类型:同步测试
一、单选题
-
1. 下列物质的化学式、俗名与分类均正确的是 ( )
A、Na2CO3 纯碱 碱 B、CaO 生石灰 氧化物 C、O2 臭氧 单质 D、NaHCO3 苏打 盐2. 在发酵面团中加入下列某种物质的溶液揉和,既能除去面团中的酸,又能使蒸出的馒头疏松多孔.这种物质是( )
A、氯化钠 B、碳酸钠 C、氢氧化钠 D、氧化钙3. 精盐是由粗盐提纯而来,在提纯过程中通常不需要的操作是( )A、吸附 B、蒸发 C、过滤 D、溶解4. 下列关于利用海水的叙述中,正确的是( )A、海底蕴藏着无以计数的能源,所以我们不用担心未来能源问题 B、之所以可以大规模利用海水制取镁,是因为镁盐是海水晒盐的产物之一 C、除镁之外,溴、碘等也可以利用海水大量制取 D、现在,通过淡化海水可以得到充足的淡水,所以“珍惜每一滴水”的理念过时了5. 日晒海水可以得到食盐固体,其原因是( )
A、受热时食盐的溶解度降低 B、受热时食盐的溶解度显著增大 C、受热时海水中的水分蒸发 D、受热时海水发生分解6. 不能影响物质溶解度大小的因素是( )A、溶质、溶剂的质量 B、温度高低 C、溶剂的性质 D、溶质的性质7. 下列反应属于复分解反应的是( )A、CaO+H2O═Ca(OH)2 B、Zn+H2SO4=ZnSO4+H2↑ C、2H2O2 2H2O+O2↑ D、Na2CO3+Ca(OH)2═CaCO3↓+2NaOH8. Na2CO3的水溶液呈碱性,下列说法错误的是 ( )
A、碳酸钠在水中能直接解离出OH- B、往碳酸钠溶液中加稀硫酸后溶液的pH减小 C、碳酸钠溶液中存在OH- D、往碳酸钠溶液中滴加紫色石蕊试液后溶液显蓝色9. 在粗盐提纯的实验中,若过滤后滤液仍浑浊,不可能是( )A、滤纸破了 B、漏斗下端没有紧靠烧杯内壁 C、液面高于滤纸边缘 D、承接滤液的烧杯没洗干净10. 不能用降低温度的方法使大量溶质从饱和溶液中析出的是( )A、KNO3溶液 B、NH4NO3溶液 C、Ca(OH)2溶液 D、NH4Cl溶液11. 能在同一溶液中大量共存,且溶液为无色透明的一组物质是( )
A、FeCl3 , CuSO4 , NaCl B、BaCl2、Na2SO4、NaOH C、CaCl2、NaNO3、AgNO3 D、K2SO4、NaNO3、NH4Cl12. 20℃时,在三个各盛有100g水的容器中分别加入甲、乙、丙三种纯净物(不含结晶水,不与水反应)各10g,充分溶解后,情况如下表:物质
甲
乙
丙
未溶解固体的质量/g
5
2
0
下列说法正确的是( )
A、所得溶液一定都是饱和溶液 B、丙溶液一定是不饱和溶液 C、丙溶液溶质的质量分数最大 D、20℃时,甲的溶解度最大13. 70℃时的m g硝酸钾的不饱和溶液,在恒温下蒸发水分至有较多的晶体析出,然后冷却至30℃并保持温度不变.能正确表示此过程中溶质质量分数(x%)与时间(t)的关系的示意图是
A、 B、
B、 C、
C、 D、
D、 14. 我国化学家侯德榜创立了著名的“侯氏制碱法”(流程简图如图),反应原理为NH3+H2O+CO2+NaCl=NH4Cl+NaHCO3(析出),促进了世界制碱技术的发展。下列说法正确的是( )
14. 我国化学家侯德榜创立了著名的“侯氏制碱法”(流程简图如图),反应原理为NH3+H2O+CO2+NaCl=NH4Cl+NaHCO3(析出),促进了世界制碱技术的发展。下列说法正确的是( )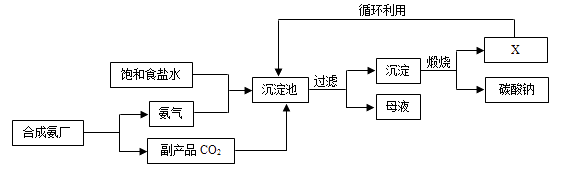 A、沉淀池中的反应物共含有4种元素 B、通入氨气的作用是使溶液呈碱性,促进二氧化碳的吸收,更多地析出沉淀 C、图中X可能是氨气 D、过滤得到的“母液”中一定只含有两种溶质
A、沉淀池中的反应物共含有4种元素 B、通入氨气的作用是使溶液呈碱性,促进二氧化碳的吸收,更多地析出沉淀 C、图中X可能是氨气 D、过滤得到的“母液”中一定只含有两种溶质二、填空题
-
15. 氯化钠和碳酸钠晶体的溶解度(0~30℃)如下表所示。根据表中数据分析,下列说法错误的是( )
 A、碳酸钠晶体的溶解度受温度的影响较大 B、将等质量的氯化钠和碳酸钠饱和溶液从30℃降至0℃,析出相同质量的晶体 C、氯化钠和碳酸钠晶体的溶解度相等时所对应的温度范围在20~30 ℃之间 D、除去碳酸钠浓溶液中含有的少量氯化钠,可用冷却结晶法16. 现有六种物质①二氧化碳、②熟石灰、③盐酸、④碳酸氢钠、⑤氯化钠、⑥苛性钠。请选择合适物质的序号填空:(1)、可用于治疗胃酸过多症的是。(2)、农业上常用来降低土壤酸性的是。(3)、厨房常用的调味品的主要成分是。(4)、能用来灭火的是。17. 海洋是巨大的资源宝库,从化学的视角看:
A、碳酸钠晶体的溶解度受温度的影响较大 B、将等质量的氯化钠和碳酸钠饱和溶液从30℃降至0℃,析出相同质量的晶体 C、氯化钠和碳酸钠晶体的溶解度相等时所对应的温度范围在20~30 ℃之间 D、除去碳酸钠浓溶液中含有的少量氯化钠,可用冷却结晶法16. 现有六种物质①二氧化碳、②熟石灰、③盐酸、④碳酸氢钠、⑤氯化钠、⑥苛性钠。请选择合适物质的序号填空:(1)、可用于治疗胃酸过多症的是。(2)、农业上常用来降低土壤酸性的是。(3)、厨房常用的调味品的主要成分是。(4)、能用来灭火的是。17. 海洋是巨大的资源宝库,从化学的视角看:
(1)、元素资源:海水中含量最高的金属元素是(填元素符号);从物质在水中溶解的规律和水天然循环的角度看,该元素含量最高的原因是 .(2)、淡水资源:淡化海水可以用(填字母代号);A.吸附法 B.蒸馏法 C.过滤法 D.电解法
该过程是(填“化学变化”或“物理变化”).
(3)、矿产资源:海底蕴藏着大量的“可燃冰”(含甲烷),甲烷燃烧的化学反应方程式为 .(4)、你还知道海洋中有哪些资源?(写一种)18. 某化学试剂厂A、B、C、D四个车间排放的污水中分别含有污染物CuCl2、HCl、Na2CO3、NaOH中的一种,现对污水做如下处理:①将A的污水与B的蓝色污水通入第一反应池,产生蓝色沉淀。
②将C的污水与D的酸性污水通入第二反应池,产生大量气泡。
③将第一反应池上层的碱性污水与第二反应池流出的酸性污水通入第三反应池,最终流出的水呈中性,再向外排放。试回答下列问题:
①各车间水中的污染物分别是A、B、C 、D。
②最终向外排放的水中含有的溶质是。
③写出第三反应池的化学方程式:。
19. 食盐是一种重要的化工原料,请回答下列问题。
(1)、请完善实验室除去粗盐中泥沙等难容性杂质的实验步骤。
①操作Ⅰ所用的玻璃仪器有:烧杯、玻璃棒和。
②蒸发过程中,待 时,停止加热,利用余热将滤液蒸干。
(2)、由于粗盐中含有少量MgCl2、CaCl2、Na2SO4等杂质,不能满足化工生产的要求,因此必须将粗盐进行精制,流程如图: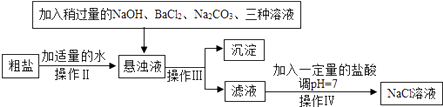
①加入稍过量的Na2CO3溶液除了能除去粗盐中的CaCl2外,它还有一个作用是(用化学方程式表示)。
②通过操作Ⅲ所得滤液中的溶质有(用化学式表示)。
(3)、若有溶质质量分数为10%的氯化钠不饱和溶液100kg,要将其变成20℃时氯化钠的饱和溶液,以满足化工生产的需要,可采用的最简便方法是 。(已知:20℃时氯化钠的溶解度为36g。)20. 根据固体物质M在水中的溶解度曲线图,回答下列问题: (1)、B点所表示的溶液为M在t2℃的(选填“饱和”或“不饱和”)溶液.(2)、将A点对应的溶液从t1℃升温到t2℃(忽略水的蒸发),在此过程中M的质量分数(选填“增大”、“减小”或“不变”);(3)、将A点对应的100g溶液恒温蒸发10g水,可析出M的质量为g,剩下的溶液中M的质量分数为21. 工业上可以用食盐和石灰石为原料制取纯碱(Na2CO3),生产的关键是在沉淀池中让NaCl、NH3、CO2和H2O尽可能多地转化成NaHCO3(固体沉淀物)和NH4Cl(溶液),主要生产流程如图所示:
(1)、B点所表示的溶液为M在t2℃的(选填“饱和”或“不饱和”)溶液.(2)、将A点对应的溶液从t1℃升温到t2℃(忽略水的蒸发),在此过程中M的质量分数(选填“增大”、“减小”或“不变”);(3)、将A点对应的100g溶液恒温蒸发10g水,可析出M的质量为g,剩下的溶液中M的质量分数为21. 工业上可以用食盐和石灰石为原料制取纯碱(Na2CO3),生产的关键是在沉淀池中让NaCl、NH3、CO2和H2O尽可能多地转化成NaHCO3(固体沉淀物)和NH4Cl(溶液),主要生产流程如图所示:
(已知2NH4Cl+Ca(OH)2 CaCl2+2NH3↑+2H2O)
(1)、“煅烧炉”中发生反应的化学方程式是。(2)、若在实验室里分离“设备(I)”中的混合物,用到的操作名称是。(3)、“沉淀池”中的反应是在加压的条件下不断向食盐水和饱和氨水溶液中通入二氧化碳气体,试分析该流程需要加压条件的原因是。(4)、“设备(Ⅱ)”中固体A与水反应的化学方程式是。(5)、对“设备(Ⅱ)”中的母液处理后,除水以外可在本流程中再利用的物质有(填写化学式)。(6)、请写出一个该生产流程的优点:。22. 将锌和硫酸锌(不含结晶水)的混合物20.8 g放入179.6 g稀硫酸中,恰好完全反应,得到200 g硫酸锌不饱和溶液。求:
(1)、原混合物中锌单质的质量分数。
(2)、稀硫酸中硫酸的质量分数。
(3)、反应后所得硫酸锌溶液的质量分数。