鲁教版九年级下学期化学同步测试 :第九章第一节 常见的金属材料
试卷更新日期:2018-03-27 类型:同步测试
一、单选题
-
1. 下列生活用品用金属材料制作而成的是( )A、陶瓷杯
 B、不锈钢碗
B、不锈钢碗  C、塑料盆
C、塑料盆  D、玻璃茶壶
D、玻璃茶壶  2. 化学造福人类。下列金属材料的冶炼和应用(如图)体现了人类社会不断发展、进步的是( )
2. 化学造福人类。下列金属材料的冶炼和应用(如图)体现了人类社会不断发展、进步的是( ) A、①②③④ B、只有②③④ C、只有①③④ D、只有③④3. 唐太宗曾说:以铜为镜可以正衣冠,以古为镜可以知兴替,以人为镜可以明得失……铜之所以能为镜是因为( )
A、①②③④ B、只有②③④ C、只有①③④ D、只有③④3. 唐太宗曾说:以铜为镜可以正衣冠,以古为镜可以知兴替,以人为镜可以明得失……铜之所以能为镜是因为( )
A、铜有金属光泽 B、铜能导热 C、铜能做工艺品 D、铜不会生锈4. 青铜是人类最早使用的铜、锡合金,下列说法中不正确的是( )A、青铜属于纯净物 B、青铜属于金属材料 C、青铜的硬度比铜大 D、青铜耐腐蚀,易铸造成形5. 下列物质中不具有金属特性的是( )
A、生铁 B、硬铝 C、氧化铁 D、24K黄金6. 下列说法正确的是( )A、铝是人类最早利用的金属材料 B、铜是目前世界年产量最高的金属 C、大多数金属元素在自然界中以单质形式存在 D、日常使用的金属材料大多数是合金7. 同学们讨论金属的共性时发表不同的看法,其中正确的是( )
A、 B、
B、 C、
C、 D、
D、 8.
8.下列设计中不符合实验设计意图的是( )
 A、说明CO具有还原性 B、说明生成物CO2的密度比空气大 C、说明CO和Fe2O3的反应需要加热 D、可以防止有毒的CO气体对空气的污染9. 鞍钢集团全力支持上海世博会,为上海虹桥交通枢纽建设提供4.7万吨精品钢材。关于钢的说法错误的是( )A、钢是一种铁合金 B、钢的许多性能优于生铁 C、钢的含碳量高于生铁 D、钢是一种混合物10. 生铁和钢都是铁的合金。下表对生铁和钢的成分、性能作了比较。
A、说明CO具有还原性 B、说明生成物CO2的密度比空气大 C、说明CO和Fe2O3的反应需要加热 D、可以防止有毒的CO气体对空气的污染9. 鞍钢集团全力支持上海世博会,为上海虹桥交通枢纽建设提供4.7万吨精品钢材。关于钢的说法错误的是( )A、钢是一种铁合金 B、钢的许多性能优于生铁 C、钢的含碳量高于生铁 D、钢是一种混合物10. 生铁和钢都是铁的合金。下表对生铁和钢的成分、性能作了比较。生 铁
钢
含碳量
2%~4.3%
0.03%~2%
性能
硬而脆、无韧性、可铸、不可煅轧
坚硬而有韧性、可铸、可煅轧
根据表中提供的信息,回答下列问题:
(1)、与生铁相比,钢有什么优良的性能?(答出一条即可)。
(2)、写出钢的一条用途:。(3)、比较生铁与钢的成分,说明生铁与钢在性能上有较大差异的主要原因:。11. 阅读下表,综合考虑表格各方面的因素,回答以下问题: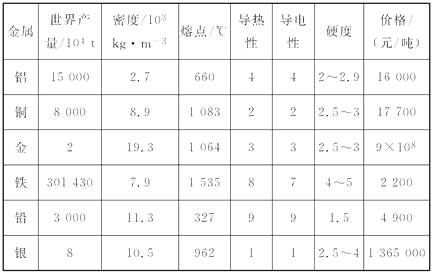
(注:表中导热性能、导电性能和硬度数值由大到小,表明导热、导电性能由弱到强;硬度由大到小。)
(1)、导电性能最好的两种金属是 , 其中更适合做导线,原因是。(2)、为什么炒菜时铝锅的锅底容易变形而铁锅的锅底却不容易变形?。(3)、铅的密度较大,而镰刀、锤子不能用铅制的原因是 , 应选用的金属是。12. 金属、金属材料的性质在很大程度上决定了它们的用途。下列相关说法中不正确的是( )A、钛合金与人体具有很好的“相容性”,可以用来制造人造骨 B、铁有良好的导热性,可以用来制炊具 C、不锈钢的抗腐蚀性好,常用于制造医疗器械 D、铅锑合金的熔点较低,常用于制成发热体13. 焊锡是锡铅合金,把铅加入锡中制成合金的主要目的是( )
A、增加强度 B、降低熔点 C、增加延展性 D、增强抗腐蚀性14. 下列有关铁的说法不正确的是( )A、生铁和钢都是铁合金 B、铁是地壳中含量最多的金属元素 C、工业炼铁的原理是:3CO+Fe2O3 2Fe+3CO2 D、用铁制作铁锅利用了铁的导热性15. 工业上将赤铁矿炼成铁是一个复杂的过程,炼铁高炉中发生的主要反应有( )①C+O2 CO2②Fe2O3+3H2 2Fe+3H2O
③Fe2O3+3CO 2Fe+3CO2
④2Fe2O3+3C 4Fe+3CO2↑
⑤CO2+C 2CO
A、②③⑤ B、①③⑤ C、①④⑤ D、②③二、填空题
-
16. 请从铜、锌、钛、铁、钙、银、铝、汞、钨等金属中选取合适的答案填入下面空格中:(1)、用于干电池的是;(2)、广泛应用于电视、微机中作导体的是;(3)、广泛用于航空、航天及化学工业的是;(4)、铁栏杆外层涂料的“银粉”大多是;(5)、体温计中银白色的液体是;(6)、热水瓶内胆壁常镀一层银白色物质中有;(7)、世界年产量最高的金属是。17. 已知草酸(H2C2O4)固体与浓硫酸共热发生化学反应:H2C2O4 CO2↑+CO↑+H2O。某化学兴趣小组同学设计如下实验装置,用于制取纯净干燥的CO气体来还原氧化铁。请根据题目要求回答下列问题:
 (1)、实验开始时,应首先点燃处的酒精灯(填装置序号)。
(1)、实验开始时,应首先点燃处的酒精灯(填装置序号)。
(2)、装置B中NaOH的作用是;C中所盛的液体是。
(3)、D装置玻璃管中观察的现象是 , 反应的方程式为。(4)、从E装置出来的尾气要进行处理,是因为尾气中含有。18. 金属材料在生活、生产中应用十分广泛。 (1)、图1是金属的一个应用实例,请说出利用了金属的什么物理性质?。(答出一点即可)(2)、图2中两块金属片互相刻划后,在纯铜片上有明显的划痕。该实验探究的目的是。(3)、将绿豆粒大小的金属焊锡、锡和铅放置在铁片上(呈三角形摆放),加热铁片的中心部分(使三种金属材料温度同步上升),可以观察到焊锡稍加热即熔化,继续加热锡熔化,铅最后熔化。该实验结论是。
(1)、图1是金属的一个应用实例,请说出利用了金属的什么物理性质?。(答出一点即可)(2)、图2中两块金属片互相刻划后,在纯铜片上有明显的划痕。该实验探究的目的是。(3)、将绿豆粒大小的金属焊锡、锡和铅放置在铁片上(呈三角形摆放),加热铁片的中心部分(使三种金属材料温度同步上升),可以观察到焊锡稍加热即熔化,继续加热锡熔化,铅最后熔化。该实验结论是。
19. 我市某化工厂排放的尾气中除含CO2外,还可能含有CO等气体。为确认CO气体是否存在,实验小组利用下列装置进行了检验,请回答下列问题: (1)、在实验时,上述装置的连接顺序是:A→B→C→B。其中A装置的作用是 , 第一次B装置的作用为。(2)、若CO气体存在,则装置C中实验现象为 , 反应的化学方程式为。(3)、从环境保护的角度考虑,你认为该实验的设计应如何改进?请写出一种改进方法:。
(1)、在实验时,上述装置的连接顺序是:A→B→C→B。其中A装置的作用是 , 第一次B装置的作用为。(2)、若CO气体存在,则装置C中实验现象为 , 反应的化学方程式为。(3)、从环境保护的角度考虑,你认为该实验的设计应如何改进?请写出一种改进方法:。三、简答题
-
20. 某钢铁厂每天消耗4 000 t含Fe2O3 80%的赤铁矿石,该钢铁厂理论上可日产含Fe 98%的生铁质量是多少?(计算结果保留到0.1)
四、实验题
-
21. 钢铁产业是我国的支柱产业之一,选择优质炼铁原料十分重要。甲、乙两组同学对某钢铁厂所购进的赤铁矿粉中主要成分Fe2O3的含量进行测定。(假设每步反应均能完全进行,赤铁矿粉中杂质性质稳定,既不溶于水也不参与反应,浓硫酸可吸收水蒸气)
 (1)、甲组同学称取一定质量的赤铁矿粉,采用如图的装置进行实验。
(1)、甲组同学称取一定质量的赤铁矿粉,采用如图的装置进行实验。①装置A中发生反应的化学方程式是。
②为充分吸收反应生成的CO2 , 装置B中应盛放的试剂是浓溶液。
③可以通过下面不同的方法计算赤铁矿粉中Fe2O3的含量:
【方法一】称量反应前后A装置的总质量,计算出Fe2O3的含量;
【方法二】称量得出反应生成的CO2的质量,计算出Fe2O3的含量。
(2)、乙组同学称取等质量的赤铁矿粉放入烧杯中,向烧杯中加入过量的稀硫酸充分反应(氧化铁与稀硫酸反应生成硫酸铁和水),(填一个操作名称)后立即称量。根据称量的数据计算出Fe2O3的含量。(3)、甲、乙两组同学通过相互比较后对各自的实验方案进行评价。方案
优 点
甲组
乙组
-