四川省绵阳市2018年中考化学二诊试卷
试卷更新日期:2018-03-23 类型:中考模拟
一、单选题
-
1. 我们学化学、用化学、爱化学,让化学知识服务于人类.下列叙述正确的是( )
A、用甲醛的水溶液浸泡海产品保鲜 B、尿素(CO(NH2)2)、HNO3、NH4HCO3中都含氮元素,可用作氮肥 C、不锈钢、玻璃钢都是金属材料,可以作医疗手术器械 D、洗洁精含有乳化剂,可以除去油污2. 下列知识归纳有错误的一组是( )A 物质组成
B 化学与生活
苏打、纯碱化学式都是Na2CO3
蔗糖、葡萄糖、淀粉都属于糖类物质
酒精、汽油、液化气﹣﹣是易燃物
油锅着火、电器着火﹣﹣用水浇灭
C 物质与变化
D 食品与健康
煤的干馏、汽油燃烧﹣﹣是化学变化
碳铵与草木灰混用﹣﹣产生氨气而降低肥效
重金属中毒﹣﹣喝鸡蛋清解毒
人体缺碘﹣﹣多吃海带、紫菜、海鲜
A、A B、B C、C D、D3. 实验室制取CO2的有关操作如下图,不正确的是( )A、检查气密性 B、制气
B、制气  C、收集
C、收集  D、验满
D、验满  4. 下列应用的原理( 用化学方程式表示)及基本反应类型均正确的是( )A、用赤铁矿高炉炼铁 Fe2O3+3CO高温2Fe+3CO2 置换反应 B、硫酸厂污水可用熟石灰中和处理 H2SO4+Ca(OH)2=CaSO4+H2O 复分解反应 C、加热混有二氧化锰的氯酸钾制取氧气 2KClO3 2KCl+3O2↑分解反应 D、用红磷测定空气中氧气含量 4P+5O2点燃2P2O5 氧化反应5. 如表中除去物质所含少量杂质的方法,错误的是( )
4. 下列应用的原理( 用化学方程式表示)及基本反应类型均正确的是( )A、用赤铁矿高炉炼铁 Fe2O3+3CO高温2Fe+3CO2 置换反应 B、硫酸厂污水可用熟石灰中和处理 H2SO4+Ca(OH)2=CaSO4+H2O 复分解反应 C、加热混有二氧化锰的氯酸钾制取氧气 2KClO3 2KCl+3O2↑分解反应 D、用红磷测定空气中氧气含量 4P+5O2点燃2P2O5 氧化反应5. 如表中除去物质所含少量杂质的方法,错误的是( )选项
物质
所含杂质
除去杂质的方法
A
氮气
氧气
将气体缓缓通过足量的灼热铜网
B
氧化钙
碳酸钙
高温煅烧
C
氯化钙溶液
盐酸
加过量氢氧化钙溶液
D
氯化钠溶液
氯化镁
加过量氢氧化钠溶液,过滤、再向滤液中加适量稀盐酸至溶液pH=7
A、A B、B C、C D、D6. 某溶液含有Cu(NO3)2和AgNO3 , 现向其中加入一定量的锌粉,参加反应的锌的质量与溶液中金属离子种类的关系(如图所示)。下列说法不正确的是( ) A、a~b间(不含两点)的溶液中金属离子为Zn2+、Ag+、Cu2+ B、c~d间(不含两点)的溶液中金属离子为Zn2+、Cu2+ C、当参加反应的锌的质量为m3时,溶液中金属离子为Zn2+ D、当参加反应的锌的质量分别为m1、m2时,溶液中Cu(NO3)2的质量分数相等7. 取4份等质量的KClO3 , 向其中3份中分别加入少量等质量的KMnO4、MnO2和Mn,分别在某温度下加热至质量不再改变,测定产生氧气的质量.然后将剩余固体溶于足量水中,添加过少量物质的组别中均有相同组成的不溶物.测定结果如下:
A、a~b间(不含两点)的溶液中金属离子为Zn2+、Ag+、Cu2+ B、c~d间(不含两点)的溶液中金属离子为Zn2+、Cu2+ C、当参加反应的锌的质量为m3时,溶液中金属离子为Zn2+ D、当参加反应的锌的质量分别为m1、m2时,溶液中Cu(NO3)2的质量分数相等7. 取4份等质量的KClO3 , 向其中3份中分别加入少量等质量的KMnO4、MnO2和Mn,分别在某温度下加热至质量不再改变,测定产生氧气的质量.然后将剩余固体溶于足量水中,添加过少量物质的组别中均有相同组成的不溶物.测定结果如下:
已知m1>m2>m3 , 下列关于此实验的说法一定正确的是( )
A、KMnO4是KClO3分解制氧气的最佳催化剂 B、残留不溶性物质的质量关系为w1>w2>w3 C、不加入其他物质,KClO3不会发生分解反应 D、3种物质的加入都有利于KClO3分解制氧气8. 科学家正在研究如下图所示的循环体系。
从图中分析得出的下列结论正确的是( )
①该技术符合低碳经济的理念 ②该过程所用的催化剂一定是二氧化锰
③该体系有一种可循环利用的物质是氢气 ④该技术有助于缓解全球面临的能源危机
⑤二氧化碳与氢气在复合催化剂条件下反应的产物是混合物
A、①②④ B、①③⑤ C、②③⑤ D、①④⑤9. 将50克镁和铁的混合物与足量的稀硫酸反应产生3.6克氢气,将反应后的溶液蒸发结晶,得到无水硫酸盐,其质量为( )A、226.4克 B、222.8克 C、172.8克 D、无法计算二、综合题
-
10. 如图是甲、乙、丙三种物质的溶解度曲线.回答下列问题:
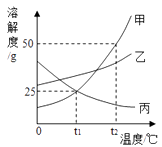
①t1℃时,甲的溶解度为;
②现有甲、乙、丙三种物质的浓溶液,适用海水晒盐原理进行结晶提纯的是;
③t3℃时,甲的饱和溶液中含有少量的丙,现要提纯甲可采用的方法是;
④下列说法正确的是 .
A.t2℃时把50g甲放入50g水中所得到甲的饱和溶液中溶质与溶液的质量比为1:2
B.t2℃时,等质量的甲、乙、丙分别制成饱和溶液,需水的质量最多的是甲
C.t1℃时,甲、乙、丙三种溶液分别升温,其浓度都不可能发生变化
D.t1℃时,向100g20%甲的饱和溶液中加100g水,充分搅拌,溶液的浓度为10%
E.t2℃时,将甲、乙、丙三种物质的饱和溶液降温至t1℃,这三种溶液的溶质质量分数的大小关系是乙>甲=丙
F.t1℃时,甲、乙、丙三种溶液的浓度可能相等.
11. 化学能转化为电能,在生产、生活中有重要的应用.①氢氧燃料电池是符合绿色化学理念的新型电池.图1是氢氧燃料电池的示意图,电池工作时,H2和O2反应生成水,同时提供电能,电池中溶液的pH(填“变大”“变小”“不变”).
②某学校研究小组对废干电池筒内的黑色物质(可能含有MnO2、ZnCl2、NH4Cl等)进行研究.查资料得知:NH4Cl具有铵态氮肥的性质;ZnCl2溶液中逐滴滴入稀氨水,先生成Zn(OH)2白色沉淀,然后沉淀溶解,生成可溶性的[Zn(NH3)4]Cl2 .
据此,小组同学进行了如下实验探究(图2):
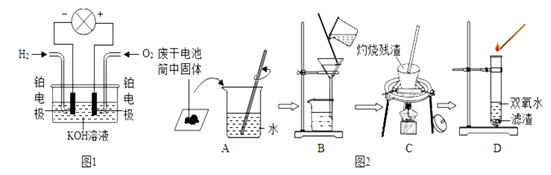
I.操作B中玻璃棒的作用是 , 操作C中灼烧黑色滤渣时,会产生一种使澄清石灰水变浑浊的气体,操作D的试管中产生的气体使带火星的木条复燃.由此得出结论:黑色滤渣中含有 .
Ⅱ.操作D的试管中产生无色气体的化学方程式是 .
Ⅲ.取少量滤液于试管中并逐滴加入 , 观察到 . 由此得出结论:操作B的滤液中含有ZnCl2 .
三、推断题
-
12. 如图表示初中常见几种不同化合物之间的关系,图中虚线两端的化合物可以转化或相互反应,箭头表示物质间存在转化关系;反应条件、部分反应物和生成物已略去.请根据以下每小题的具体情况进行解答.
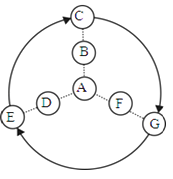
①若A能与B、F、D分别反应,C、G、E能顺时针转化.B、F、D又分别能转化生成C、G、E.已知:B与D、C与E、F与G分别为相同类型的物质.A是胃酸的主要成分,F中元素质量比为7:3.那么A与F反应的化学方程式为 ,
C转化成G的化学方程式为 (写一个即可).
②若C、G、E依次能向中心转化,最终生成A.且C、G、E能顺时针转化.已知:C、G、E含有两种相同的元素,A、B、D、F也都含有两种相同的元素,A能产生温室效应,G是这几种物质中相对分子质量最小的.那么A的化学式为 , E转化成C的化学方程式为 .
四、科学探究题
-
13. 某实验小组在研究酸的化学性质时,做了如图丙所示5个实验.
①实验后,某试管中溶液呈浅绿色,该试管中发生反应的化学方程式为 .
②实验后,向某试管中滴加无色酚酞,溶液变红,再向此试管中加稀盐酸,只观察到溶液由红色变为无色.据此推断,该试管中最初发生的反应的化学方程式可能为:(写一个即可).
③将②反应后的溶液,与上述五支试管中某试管反应后的溶液混合,看到先产生气体,后出现沉淀.则混合后溶液中溶质可能为(写一种即可).
④科学实验提倡绿色环保,对实验装置进行微型化改进是一条很好的途径.如图甲是实验时制取并检验CO2的装置,图乙是对图甲实验装置微型化改进后的装置.
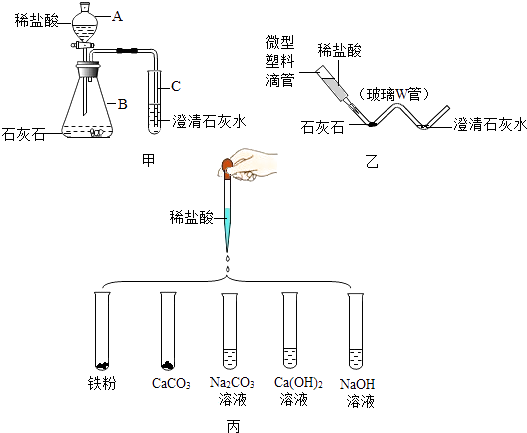
I.图乙中微型塑料滴管在实验中的作用与图甲中的(填字母编号)仪器相同;
Ⅱ.通常用甲装置完成该实验需要的盐酸是微型实验装置用量的10倍,采用微型实验装置具有的优点是 .
五、填空题
-
14. 煤燃烧后的产物主要是CO2 , 也含有一定量的SO2 , 还可能含有CO 。小明同学进行环境调查时发现:荆开火力发电厂(以煤为燃料)周围的树木已渐枯萎,发电厂排放的废气中也可能含CO 。他将收集的废气样品用下图所示装置恰当组合后进行检验,已知其中的药品均足量。请回答下列问题:
 (1)、上述装置中,仪器A的名称叫;(2)、你认为发电厂周围树木枯萎的原因可能是;(3)、为确定发电厂排放的废气中是否含CO ,请根据拟定的气体流向,确定并填写组合装置中各导管口(用代号表示)的连接顺序:
(1)、上述装置中,仪器A的名称叫;(2)、你认为发电厂周围树木枯萎的原因可能是;(3)、为确定发电厂排放的废气中是否含CO ,请根据拟定的气体流向,确定并填写组合装置中各导管口(用代号表示)的连接顺序:废气→( )→( )→( )→( )→( )→( )→尾气处理
(4)、实验结果证明该发电厂排放的废气中含有CO 。则实验过程中与此相关的实验现象有 ; , 上述现象对应的化学反应方程式依次为;。(5)、请说明你对该实验尾气的处理方法。六、实验题
-
15. 同学们在初中化学实验室中,发现一瓶如图所示久置的瓶口有白色固体、瓶塞丢失的无色溶液。已知原溶液可能是NaCl、NaOH或Na2CO3三种溶液中的一种,为确定溶液成分,同学们进行了如下探究:
 (1)、小张同学取待测液测得pH=10,他得出的关于溶液成分的结论是。(2)、他取少量待测液于试管中,加入过量的稀HCl,看到 , 由此小张同学认为,溶液为Na2CO3溶液。(3)、小李同学对小张同学的结论提出疑问,并进行了以下实验进行验证:取少量待测液于试管中,加入过量的CaCl2溶液,生成白色沉淀,该反应方程式为 , 静置,(写出还需进行的操作及现象)。
(1)、小张同学取待测液测得pH=10,他得出的关于溶液成分的结论是。(2)、他取少量待测液于试管中,加入过量的稀HCl,看到 , 由此小张同学认为,溶液为Na2CO3溶液。(3)、小李同学对小张同学的结论提出疑问,并进行了以下实验进行验证:取少量待测液于试管中,加入过量的CaCl2溶液,生成白色沉淀,该反应方程式为 , 静置,(写出还需进行的操作及现象)。通过实验,小李认为小张结论正确。
(4)、二位同学给试剂瓶贴一新标签:Na2CO3 。实验结束后,同学们通过讨论认为试剂瓶原标签也可能不是Na2CO3 , 你认为他们的理由是。
七、简答题
-
16. 我国制碱工业的先驱——侯德榜探索发明了“侯氏制碱法”,其生产过程涉及的主要化学反应如下:
①NH2+CO2+X=NH4HCO3
②NH4HCO3+NaCl=NH4Cl+NaHCO3↓
③2NaHCO3 Na2CO3+H2O+CO2↑
请回答下列问题:
(1)、反应①中X的化学式为。
(2)、除去混在Na2CO3粉末中少量的NaHCO3的方法是。(3)、工业纯碱中含有氯化钠,取55g工业纯碱,向其中加入269.5g稀盐酸,恰好完全反应,生成22g二氧化碳,求:①工业纯碱中碳酸钠的质量分数。(计算结果保留到0.1%)
②反应后溶液中溶质的质量分数。
-
-
-
-