高中必修一化学结业考试模拟题
试卷更新日期:2018-03-22 类型:期末考试
一、单选题
-
1. 关于钠的叙述中,正确的是( )A、钠是银白色金属,硬度很大 B、将金属钠放在坩埚里用酒精灯加热,金属钠剧烈燃烧,产生黄色火焰,生成淡黄色固体过氧化钠 C、金属钠在空气中燃烧,生成氧化钠 D、金属钠的熔点很高2. 下列各组物质相互反应后,没有碱生成的是 ( )A、Na2O2溶于水 B、红热的铁和水蒸气 C、金属钠投入水中 D、Na2O投入水中3. 金属钛有“生物金属”之称。下列有关 和 的说法正确的是( )A、 和 原子中均含有22个中子 B、 和 在周期表中位置相同,都在第4纵行 C、 和 的物理性质相同 D、 和 为同一核素4. 下列关于能源的说法不正确的是( )A、物质的化学能可在不同条件下转变成热能、电能为人类所使用 B、太阳能能直接转化为化学能 C、全面推广利用氢能,禁止在任何条件下利用任何化石燃料 D、在西部和沿海地区兴建风力发电站,解决能源问题5. 下列有关混合物、纯净物、电解质、非电解质的正确组合为( )
纯净物
混合物
电解质
非电解质
A.
纯盐酸
水煤气
硫酸
干冰
B.
蒸馏水
蔗糖溶液
氧化铝
二氧化硫
C.
胆矾
氢氧化铁胶体
铁
碳酸钙
D.
水银
澄清石灰水
氯化铜
碳酸钠
A、A B、B C、C D、D6. 下列关于电解质电离的叙述中正确的是( )A、CaCO3在水中溶解度很小,其导电能力很弱,所以CaCO3是弱电解质 B、CaCO3在水中溶解度很小,但溶解的CaCO3全部电离,所以CaCO3是强电解质 C、氯气和氨气的水溶液导电性都很好,所以它们是强电解质 D、水难电离,纯水几乎不导电,水是非电解质7. 下列物质中导电性最差的是( )A、0.6 mol·L−1的硫酸 B、0.1 mol·L−1的盐酸 C、熔融的NaCl D、硝酸钾晶体8. 某无色溶液中只可能含有K+、Ag+、Ba2+、Cu2+、Cl-、OH-、CO 、SO
、SO  中的一种或几种,对其进行如下实验操作:( )
中的一种或几种,对其进行如下实验操作:( )⑴取少量溶液,滴加无色酚酞试液,酚酞变红;
⑵另取少量溶液,加入足量BaCl2溶液,产生白色沉淀;
⑶向(2)所得混合物中加足量盐酸,沉淀部分溶解,并有无色气体生成;
⑷将(3)所得混合物过滤,向滤液中加入AgNO3溶液,有白色沉淀生成。
下列对该溶液的说法正确的是
A、一定含有OH-、CO 、SO
、SO  、Cl-
B、可能含有K+、Cl-
C、一定不含有Ag+、Ba2+、Cu2+
D、无法判断
9. 当溶液中XO42- 和SO32-的离子数目之比为1∶2时,恰好完全反应,则X元素在还原产物中的化合价为( )A、+1 B、+2 C、+3 D、+410. 固体单质A和气体单质B在容积一定的密闭容器中恰好完全反应生成气体C,相同温度下测得容器内压强不变,若产物气体C的密度是原气体密度的4倍,则判断正确的是( )
、Cl-
B、可能含有K+、Cl-
C、一定不含有Ag+、Ba2+、Cu2+
D、无法判断
9. 当溶液中XO42- 和SO32-的离子数目之比为1∶2时,恰好完全反应,则X元素在还原产物中的化合价为( )A、+1 B、+2 C、+3 D、+410. 固体单质A和气体单质B在容积一定的密闭容器中恰好完全反应生成气体C,相同温度下测得容器内压强不变,若产物气体C的密度是原气体密度的4倍,则判断正确的是( )
A、单质A与B的摩尔质量之比是1∶4 B、反应前后的气体质量之比一定是1∶4 C、生成物C中,A的质量分数为50% D、生成物C中A,B两元素的原子个数比为3∶1二、填空题
-
11. 现有下列10种物质:①H2O ②空气 ③铝 ④CaO ⑤H2SO4⑥Ca(OH)2⑦CuSO4•5H2O ⑧碘酒 ⑨C2H5OH ⑩NaHCO3 ⑪碳酸钡⑫氨气 ⑬甲烷⑭稀硝酸,用序号填空:
属于混合物的是;属于氧化物的是;属于酸的是;属于碱的是;属于盐的是;属于有机物的是;可以导电的有 .
12. 久置的Ba(OH)2溶液由于吸收空气中二氧化碳而变得浑浊,要想得到澄清的溶液,可以通过来完成.(填物质分离提纯的一种方法)三、实验探究题
-
13. 硝酸在反应中的动态变化:往铜片中加入浓硝酸,回答下列问题:(1)、开始阶段实验现象为: , 反应的化学方程式为:(2)、若铜有剩余,则临近结束时的反应方程式为:(3)、当反应结束后,若通过分液漏斗向烧瓶内再加入稀硫酸,又可继续反应,产生无色无味的气体,此时的离子方程式可表示为: .14. 硫酸钠与工农业生产、生活紧密相关,工业硫酸钠大多采用侯氏制碱法制取.(1)、Ⅰ.实验室欲模拟侯氏制碱法来制备纯碱Na2CO3 , 需要的CO2气体用下图中的装置A来制备.优点是可随用随停.如图中的装置B、C、D中与A具有相同工作原理也可制备CO2气体的是(填写字母).

Ⅱ.制得的碳酸钠样品中往往含有少量NaCl,现欲测定样品中Na2CO3的质量分数,某探究性学习小组分别设计了如下实验方案.请回答下列有关问题:
方案一:把一定质量的样品溶解后加入过量的CaCL2溶液,将所得沉淀(填操作名称)、洗涤、烘干、称量、计算、洗涤沉淀的具体操作是
方案二:把一定量的样品与足量硫酸反应后,用如图1所示装置测定产生CO2的体积,为了确保测定结果的准确性,B中的溶液最好采用 . 如图装置中实验仪器a的名称是 .
 (2)、方案三:利用如图2所示装置来测定纯碱样品中碳酸钠的质量分数(铁架台、铁夹等在图中均已略去).实验步骤如下:
(2)、方案三:利用如图2所示装置来测定纯碱样品中碳酸钠的质量分数(铁架台、铁夹等在图中均已略去).实验步骤如下:①按图连接装置,并检查气密性;
②准备称得盛有碱石灰的干燥管D的质量为33.4g;
③准备称得6g纯碱样品放入容器b中;
④打开分液漏斗a的胶塞,缓缓滴入稀硫酸,至不再产生气泡为止;
⑤打开弹簧夹,往试管A中缓缓鼓入空气数分钟,然后称得干燥管D的总质量为35.6g.
1)若④⑤两步的实验操作太快,则会导致测定结果(填“偏大”或“偏小”).
2)装置A中试剂X应选用 .
3)E装置的作用是 .
4)根据实验中测得的有关数据,计算出纯碱样品Na2CO3的质量百分数为
(结果保留一位小数).
15. 某探究小组在实验室中用铝土矿(主要成分为Al2O3 , 还含有Fe2O3、SiO2)提取氧化铝.回答下列问题: (1)、在实验中需用1mol•L﹣1的NaOH溶液480mL,配制该溶液已有下列仪器:托盘天平(砝码)、胶头滴管、药匙、玻璃棒,还缺少的仪器 . 在灼烧操作中用到下列仪器中的一种,其名称是
(1)、在实验中需用1mol•L﹣1的NaOH溶液480mL,配制该溶液已有下列仪器:托盘天平(砝码)、胶头滴管、药匙、玻璃棒,还缺少的仪器 . 在灼烧操作中用到下列仪器中的一种,其名称是 (2)、写出步骤①中发生反应的离子方程式 .(3)、操作③中的洗涤操作如何进行?(4)、甲同学在实验室中用如图装置制备CO2气体,并通入滤液B中制备Al(OH)3时,结果没有产生预期现象.
(2)、写出步骤①中发生反应的离子方程式 .(3)、操作③中的洗涤操作如何进行?(4)、甲同学在实验室中用如图装置制备CO2气体,并通入滤液B中制备Al(OH)3时,结果没有产生预期现象.
乙同学分析认为:甲同学通入CO2的量不足是导致实验失败的原因之一,你认为乙的分析是否合理? . 若合理,请用离子方程式解释其原因 (若你认为不合理,该空不作答).
丙同学分析认为:甲同学通入的CO2中含有HCl气体,也是导致实验失败的原因,在实验中增加某装置可解决这个问题.请帮助丙同学画出该装置图,并注明试剂名称.
16. 硫酸亚铁晶体(FeSO4•7H2O)在医药上作补血剂.某课外小组测定该补血剂中铁元素的含量,并检验该补血剂是否变质.实验步骤如下:
请回答下列问题:
(1)、步骤①滤液中滴加KSCN溶液后滤液变为红色,则该溶液中含有(填离子符号),检验滤液中还存在Fe2+的方法为(注明试剂、现象).(2)、步骤②加入过量H2O2的目的是 .(3)、步骤③中反应的离子方程式为(4)、步骤④中一系列处理的操作步骤包括:过滤、、灼烧、、称量.(5)、若实验无损耗,则每片补血剂含铁元素的质量为 g.四、综合题
-
17. 用 表示原子:(1)、中性原子的中子数N=。(2)、AXn+共有x个电子,则该阳离子的中子数N=。(3)、AXn-共有x个电子,则该阴离子的中子数N=。(4)、12C16O2分子中的中子数N=。(5)、A2-原子核内有x个中子,其质量数为m,则n gA2-所含电子的物质的量为。18. 下表为元素周期表的一部分,请回答有关问题:
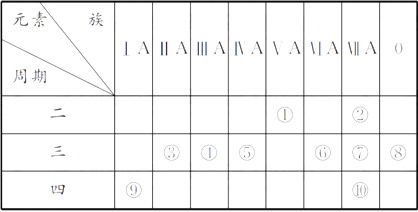 (1)、⑤和⑧的元素符号分别是和。(2)、表中最活泼的金属是 , 非金属性最强的元素是(填元素符号,下同)。(3)、表中能形成两性氢氧化物的元素是 , 分别写出该元素的氢氧化物与⑥和⑨的最高价氧化物的水化物反应的化学方程式:。(4)、请设计一个实验方案,比较⑦和⑩的单质氧化性的强弱:。19. 电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔来制造印刷电路板。
(1)、⑤和⑧的元素符号分别是和。(2)、表中最活泼的金属是 , 非金属性最强的元素是(填元素符号,下同)。(3)、表中能形成两性氢氧化物的元素是 , 分别写出该元素的氢氧化物与⑥和⑨的最高价氧化物的水化物反应的化学方程式:。(4)、请设计一个实验方案,比较⑦和⑩的单质氧化性的强弱:。19. 电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔来制造印刷电路板。①把FeO、Fe2O3先溶于足量的稀盐酸中、再通入适量的氯气则可制取FeCl3溶液。FeO、Fe2O3溶于足量的稀盐酸中,在上述溶液中通入适量的氯气时发生的反应的离子方程式为。若要检验溶液中Fe3+存在应选用的试剂是。
②写出FeCl3溶液与金属铜发生反应的化学方程式 , 当转移电子数为6.02×1024时,被氧化的物质的质量为
五、推断题
-
20. 现有金属单质A、B、C和气体甲、乙、丙及物质D、E、F、G、H,它们之间能发生如下反应(图中有些反应的产物和反应的条件没有全部标出).

请根据以上信息回答下列问题:
(1)、写出下列物质的化学式:丙 G(2)、写出下列反应的离子方程式:反应①
反应⑤
(3)、写出 乙+D的化学方程式 .