2015-2016学年浙江省金华市东阳二中高一上学期第一次调研化学试卷
试卷更新日期:2016-11-21 类型:月考试卷
一、选择题
-
1. 据报道,继通过食盐补碘在全国范围内基本实现消除碘缺乏病目标之后,我国又将启动一项涉及千家万户营MgSO4养健康问题的“补铁工程”.卫生部已批准以酱油为食物载体,逐步开展补铁工程.这里的碘、铁指的是( )A、元素 B、原子 C、分子 D、单质2. 钛(Ti)金属常被称为未来钢铁.钛元素的同位素 、 、 、 、 中,中子数不可能为( )A、30 B、28 C、26 D、243. 美国正在催日本归还超过300公斤的武器及放射物质,引发世界极大关注, Pu中的中子数与质子数之差为( )A、239 B、145 C、94 D、514. 下列萃取与分液结合进行的操作(用CCl4作萃取剂,从碘水中萃取碘)中错误的是( )A、饱和碘水和CCl4加入分液漏斗中后,塞上上口部的塞子,用一手压住分液漏斗上口部,一手握住活塞部分,把分液漏斗倒转过来振荡 B、静置,待分液漏斗中液体分层后,先使分液漏斗内外空气相通(准备放出液体) C、打开分液漏斗的活塞,使全部下层液体沿承接液体的烧杯内壁慢慢流出 D、最后继续打开活塞,另用容器承接并保存上层液体5. 化学概念在逻辑上存在如下关系:对下列概念的说法正确的是( )
 A、化合物与电解质属于重叠关系 B、化合物与碱性氧化物属于交叉关系 C、溶液与胶体属于并列关系 D、单质与非电解质属于包含关系6. 纳米材料是粒子直径为1﹣100nm的材料,其研究成果已应用于医学、化工、军事等领域.纳米碳就是其中的一种,若将纳米碳均匀地分散到蒸馏水中,下列有关形成的物质的判断正确的是( )
A、化合物与电解质属于重叠关系 B、化合物与碱性氧化物属于交叉关系 C、溶液与胶体属于并列关系 D、单质与非电解质属于包含关系6. 纳米材料是粒子直径为1﹣100nm的材料,其研究成果已应用于医学、化工、军事等领域.纳米碳就是其中的一种,若将纳米碳均匀地分散到蒸馏水中,下列有关形成的物质的判断正确的是( )①是溶液②是胶体 ③能产生丁达尔效应 ④能透过滤纸⑤不能透过滤纸⑥静置后会析出黑色沉淀.
A、①②③④ B、②③⑤⑥ C、②③④ D、②③④⑥7. 下列属于电解质并能导电的物是( )①熔融的NaCl ②KNO3溶液 ③Cu ④酒精 ⑤NaCl晶体 ⑥盐酸.
A、① B、①②③⑤⑥ C、①②⑥ D、①③④⑤8. 同温同压下,甲、乙两容器分别盛有甲烷气体和氨气,已知它们所含原子个数相同,则甲、乙两容器的体积比为( )A、4:5 B、5:4 C、4:3 D、1:19. 下列实验装置或操作与粒子的大小无直接关系的是( )A、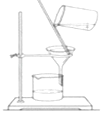 过滤
B、
过滤
B、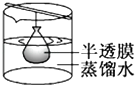 渗析
C、
渗析
C、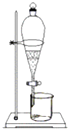 萃取
D、
萃取
D、 丁达尔效应
10. Na2O、NaOH、Na2CO3、NaCl、Na2SO4可按某种标准划为同一类物质,下列分类标准正确的是( )(已知Na2O与水反应生成NaOH)
丁达尔效应
10. Na2O、NaOH、Na2CO3、NaCl、Na2SO4可按某种标准划为同一类物质,下列分类标准正确的是( )(已知Na2O与水反应生成NaOH)①钠的化合物②能与硝酸反应的物质 ③可溶于水的物质 ④水溶液导电 ⑤钠盐 ⑥钠的含氧化合物.
A、①④⑤ B、①②⑤⑥ C、①③④ D、②⑤⑥11. 同温同压下,等体积的两容器内分别充满由14N、13C、18O三种原子构成的一氧化氮和一氧化碳,两容器含有的( )A、分子数和气体质量均不同 B、分子数和电子数均相同 C、质子数和中子数均相同 D、分子数、原子数和中子数均相同12. 以下是对某水溶液进行离子检验的方法和结论,其中正确的是( )A、先加入BaCl2溶液,再加入足量的HNO3溶液,产生了白色沉淀.溶液中一定含有大量的SO42﹣ B、加入足量的CaCl2溶液,产生了白色沉淀.溶液中一定含有大量的CO32﹣ C、加入足量浓 NaOH溶液,产生了带有强烈刺激性气味,并能使湿润的红色石蕊试纸变蓝的气体.溶液中一定含有大量的NH4+ D、先加适量的盐酸将溶液酸化,再加AgNO3溶液,产生了白色沉淀.溶液中一定含有大量的Cl﹣13. 下列有关除杂的实验操作合理的是( )A、除去二氧化碳中混有的少量一氧化碳:通入适量氧气后点燃 B、除去氧气中少量氮气:使气体通过炽热的铜粉 C、除去石英中少量碳酸钙:用稀盐酸溶解后过滤 D、除去氯化钠固体中少量的纯碱:加入足量氯化钙,过滤、蒸发、结晶14. 设NA为阿伏加德罗常数的值,下列有关说法不正确的是( )A、24g Mg变为Mg2+时失去的电子数为2NA B、含有NA个氦原子的氦气在标准状况下的体积约为22.4L C、常温常压下,22 g氧气和26 g臭氧所含氧原子总数为3 NA D、18 g重水(D2O)所含电子数为10NA15. 某溶液中含有较大量的Cl﹣、CO32﹣、OH﹣等3种阴离子,如果只取一次该溶液就能够分别将3种阴离子依次检验出来,下列实验操作顺序正确的是( )①滴加Mg(NO3)2溶液;②过滤;③滴加AgNO3溶液;④滴加Ba(NO3)2溶液.
A、①②④②③ B、④②①②③ C、①②③②④ D、④②③②①16. 为了除去粗盐中的CaCl2、MgCl2、Na2SO4及泥沙,可将粗盐溶于水,通过如下几个实验步骤,可制得纯净的食盐水:①加入稍过量的Na2CO3溶液;②加入稍过量的NaOH溶液;③加入稍过量的BaCl2溶液;④滴入稀盐酸至无气泡产生;⑤过滤 不正确的操作顺序是( )A、③②①⑤④ B、③①②⑤④ C、②③①⑤④ D、②①③⑤④17. 在强酸性溶液中,下列离子组能大量共存且溶液为无色透明的是( )A、Mg2+、Na+、SO42﹣、Cl﹣ B、Na+、Cu2+、SO42﹣、NO3﹣ C、Na+、K+、OH﹣、Cl﹣ D、Ba2+、CO32﹣、NO3﹣、K+18. 以下有关物质的量浓度的叙述正确的是( )A、等体积硫酸铁、硫酸铜、硫酸钾溶液分别与足量的氯化钡溶液反应,若生成的硫酸钡沉淀的质量比为1:2:3,则三种硫酸盐溶液的物质的量浓度比为1:2:3 B、150 mL 1 mol•L﹣1的氯化钾溶液中的c(Cl﹣)与50 mL 1 mol•L﹣1的氯化铝溶液中的c(Cl﹣)相等 C、20℃时,饱和KCl溶液的密度为1.174 g•cm﹣3 , 物质的量浓度为4.0 mol•L﹣1 , 则此溶液中KCl的质量分数为 ×100% D、20℃时,100 g水可溶解34.2 g KCl,此时KCl饱和溶液的质量分数为34.2%19. 已知元素R有某种同位素的氯化物RClX , 该氯化物中R微粒核内中子数为Y,核外电子数为Z,该同位素的符号为( )A、 B、 C、 D、20. 氢溴酸(HBr)的稀溶液与稀盐酸的化学性质十分相似,据此判断下列反应不会发生的是( )A、2HBr+Na2CO3═2NaBr+H2O+CO2↑ B、2HBr+CaCO3═CaBr2+H2O+CO2↑ C、HBr+NaOH═NaBr+H2O D、2HBr+2Ag═AgBr+H2↑21. 4.0g氢氧化钠溶于100mL水,充分振荡后,氢氧化钠溶液的物质的量浓度是( )1mol/L.A、小于 B、等于 C、大于 D、无法判断22. 一个12C原子的质量为a kg,一个12C16O2分子的质量为b kg,若以12C16O2中的一个氧原子质量的 作为相对原子质量标准,则12C16O2的相对分子质量为( )A、 B、 C、 D、23. 把100g浓度为18mol•L﹣1、密度为ρ(g•cm﹣3)的浓硫酸加到一定量的水中稀释成9mol•L﹣1的硫酸,则加入水的体积( )A、小于100mL B、等于100mL C、大于100mL D、等于100/ρmL24. 把V L含有MgSO4和K2SO4的混合溶液分成两等份,一份加入含a mol NaOH的溶液,恰好使镁离子完全沉淀为氢氧化镁;另一份加入含b mol BaCl2的溶液,恰好使硫酸根离子完全沉淀为硫酸钡.则原混合溶液中钾离子的浓度为( )A、 mol•L﹣1 B、 mol•L﹣1 C、 mol•L﹣1 D、 mol•L﹣125. A在一定温度下有分解反应A(s)═B(s)+C(g)+4D(g).若测得生成的气体的质量是同温同压下,相同体积氢气的10倍,且当所生成的气体在标况下的体积为22.4L时,所得B的质量为30.4g,A的摩尔质量为( )
A、120.4g/mol B、50.4g/mol C、182.4g/mol D、252g/mol26. 由硫酸钾、硫酸铝和硫酸组成的混合溶液,pH=1,c(Al3+)=0.4mol•L﹣1 , c(SO42﹣)=0.8mol•L﹣1 , 则c(K+)=( )A、0.15 mol•L﹣1 B、0.2 mol•L﹣1 C、0.3 mol•L﹣1 D、0.4 mol•L﹣127. 体积为V mL、密度为ρ g•cm﹣3的溶液,含有相对分子质量为M的溶质m g,其物质的量浓度为c mol•L﹣1 , 溶质的质量分数为W%,下列表示式中不正确的是( )A、c= B、m= C、W%= % D、c=28. 在V L Fe2(SO4)3溶液中,含有W g Fe3+ , 该溶液中SO42﹣的物质的量浓度是( )A、 B、 C、 D、二、填空题
-
29. O2、SO2、SO3三者质量之比为1:2:5,则它们的氧原子数之比为 .30. 11.7g NaX含有Na+0.2mol,则NaX的摩尔质量为 .31. 相同浓度的NaCl、MgCl2、AlCl3溶液,分别与AgNO3溶液反应,当生成的AgCl沉淀的质量之比为3:2:1时,三种溶液的体积比为 .32. 实验室中需要配制2mol•L﹣1的NaCl溶液950mL,配制时应称取的NaCl的质量是 .33. 某溶液中可能含有下列6种离子中的某几种:Cl﹣、SO42﹣、NH4+、CO32﹣、K+、Na+ . 为确认溶液组成进行如下实验:
①200mL上述溶液,加入足量BaCl2溶液,反应后将沉淀过滤、洗涤、干燥,得沉淀4.30g,向沉淀中加入过量的盐酸,有2.33g沉淀不溶.
②向①的滤液中加入足量的NaOH溶液,加热,产生能促使湿润红色石蕊试纸变蓝的气体1.12L(已换算成标准状况,假定产生的气体全部逸出).
(1)、溶液一定存在的离子有 , 可能存在的离子有;(2)、原溶液中c(CO32﹣)为 , c(NH4+) c(SO42﹣) (填“>、<或=”);(3)、如果上述6种离子都存在,则c(Cl﹣) c(SO42﹣) (填“>、<或=”).34. 某同学称取了4.0g NaOH固体,欲配制100mL溶液.回答下列问题:(1)、该实验中,用到的能确定体积的两种玻璃仪器是、 .(2)、操作过程中多次用到玻璃棒,其在实验中的作用有 .(3)、不规范的实验操作会导致实验结果的误差.分析下列操作对实验结果的影响(填“偏大”“偏小”或“不变”):①在溶解过程中有少量液体溅出烧杯外 .
②定容时仰视仪器上的刻度线 .
③定容后,将容量瓶振荡摇匀后,静置发现液面低于刻度线,于是又加入少量水至刻度线 .
35. 1.15g金属钠跟水反应后,得到100mL溶液,试计算:(已知方程式2Na+2H2O=2NaOH+H2↑)(1)、生成的气体在标准状况下是多少毫升?(2)、反应后所得溶液中溶质的物质的量浓度是多少?