湖北省武汉2017-2018学年高二上学期化学期末考试试卷
试卷更新日期:2018-03-19 类型:期末考试
一、单选题
-
1. 下列叙述中,不能用勒夏特列原理解释的是( )A、红棕色的NO2 , 加压后颜色先变深后变浅 B、高压比常压有利于合成SO3的反应 C、Fe(SCN)3溶液中加入固体KSCN后颜色变深 D、由H2、I2(g)、HI(g)气体组成的平衡体系加压后颜色变深2. 在同温同压下,下列各组热化学方程式中,Q1 〉Q2的是 ( )A、2H2(g)+O2(g)=2H2O(l) ;△H= Q1 2H2(g)+O2(g)=2H2O(g); △H= Q2 B、S(g)+O2(g)=SO2(g) ;△H= Q1 S(s)+O2(g)=SO2(g);△H= Q2 C、C(s)+0.5O2(g)=CO(g);△H= Q1 C(s)+O2(g)=CO2(g);△H= Q2 D、H2(g)+Cl2(g)=2HCl(g);△H= Q1 0.5H2(g)+0.5 Cl2(g)=HCl(g);△H= Q23. 下列溶液一定呈中性的是 ( )A、pH=7的溶液 B、c(H+)=c(OH-)的溶液 C、由强酸、强碱等物质的量反应得到的溶液 D、非电解质溶于水得到的溶液4. 下列说法不正确的是( )A、Ksp只与难溶电解质的性质和温度有关 B、由于Ksp(ZnS)>Ksp(CuS),所以ZnS沉淀在一定条件下可转化为CuS沉淀 C、其他条件不变,离子浓度改变时,Ksp不变 D、两种难溶电解质作比较时,Ksp小的,溶解度一定小5. 下列现象或说法与盐类水解无关的是( )A、浓的硫化钠溶液有臭味 B、加热稀醋酸溶液其pH稍有减小 C、纯碱溶液去油污 D、泡沫灭火器的使用原理6. 下列说法正确的是( )A、所有反应的活化能不可能接近零 B、弱电解质的导电性不一定比强电解质的导电性弱 C、燃烧热是指1 mol任何物质完全燃烧生成稳定氧化物所放出的热量 D、H+ (aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ·mol-1表示强酸溶液与强碱溶液反应的中和热7. 下列各组离子一定能大量共存的是( )A、在强碱溶液中:Na+、K+、AlO2﹣、CO32﹣ B、在pH=0的溶液中:K+、Fe2+、Cl﹣、NO3﹣ C、在含大量Fe3+的溶液中:NH4+、Na+、Cl﹣、SCN﹣ D、在c(H+)=10﹣13mol/L的溶液中:NH4+、Al3+、SO42﹣、NO3﹣8. 下列式子属于水解反应,且溶液呈酸性的是 ( )A、HCO3- + H2O H3O+ + CO32- B、Fe3+ + 3H2O Fe(OH)3 + 3H+ C、HS- + H2O H2S + OH- D、NH4+ + OH- NH3↑+ H2O9. 下列关于判断过程的方向的说法正确的是( )A、所有自发进行的化学反应都是放热反应 B、同一物质的固、液、气三种状态的熵值相同 C、高温高压下可以使石墨转化为金刚石是自发的化学反应 D、由能量判据和熵判据组合而成的复合判据,将更适合于所有的过程10. 一定量的锌粉和6mol/L的过量盐酸反应,当向其中加入少量的下列物质时,能够加快反应速率,但不影响产生H2的总量的是( )
①铜粉 ②铁粉 ③石墨粉 ④CuO ⑤浓盐酸 ⑥碳酸钠 ⑦醋酸钠
A、①③⑤ B、②③⑤⑦ C、①③④⑤ D、④⑤⑥11. 在1 L密闭容器中,把1 mol A和1 mol B混合发生如下反应:3A(g)+B(g) xC(g)+2D(g),当反应达到平衡时,生成0.4 mol D,并测得C的平衡浓度为0.4 mol/L,下列叙述中不正确的是( )A、x的值为2 B、A的转化率为60% C、B的平衡浓度为0.8 mol/L D、D的体积分数为25%12. 现有浓度为1 mol/L的五种溶液:①HCl,②H2SO4 , ③CH3COOH,④NH4Cl,⑤NaOH,由水电离出的C(H+)大小关系正确的是( )A、④>③>①=⑤>② B、①=②>③>④>⑤ C、②>①>③>④>⑤ D、④>③>①>⑤>②13. 用蒸馏水逐步稀释0.2 mol/L的稀氨水时,若温度不变,在稀释过程下列数据始终保持增大趋势的是( )A、c(OH-) B、c(NH4+) C、c(NH3·H2O) D、c(NH4+)/c(NH3·H2O)14. 已知某温度下,四种一元弱酸的电离平衡常数为:Ka(HCN)= 6.2×10-10mol/L、Ka(HF)= 6.8×10-4mol/L、Ka(CH3COOH)= 1.8×10-5mol/L、Ka(HNO2)= 6.4×10-6mol/L。物质的量浓度都为0.1 mol/L的下列溶液中,pH最小的是( )A、HCN B、CH3COOH C、HF D、HNO215. 利用下图装置进行实验,开始时,a、b两处液面相平,密封好,放置一段时间。下列说法不正确的是 ( ) A、a管发生吸氧腐蚀,b管发生析氢腐蚀 B、一段时间后,a管液面高于b管液面 C、a处溶液的pH增大,b处溶液的pH减小 D、a、b两处具有相同的电极反应式:Fe-2e-= Fe2+16. 镍镉(Ni-Cd)可充电电池在现代生活中有广泛应用。已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:Cd + 2NiOOH + 2H2O Cd(OH)2 + 2Ni(OH)2 , 有关该电池的说法正确的是( )A、充电时阳极反应:Ni(OH)2 -e- + OH- = NiOOH + H2O B、充电过程是化学能转化为电能的过程 C、放电时负极附近溶液的碱性不变 D、放电时电解质溶液中的OH-向正极移动17. 25℃时pH=13的强碱与pH=2的强酸溶液混合,所得混合液的pH=11,则强碱与强酸的体积比为( )A、9:1 B、1:11 C、1:9 D、11:118. 已知某可逆反应:mA(g)+nB(g) r C(g)在密闭容器中进行。下图表示此反应在不同时间t,温度T和压强p与反应物B在混合气体中的百分含量(B%)的关系曲线。由曲线分析下列判断正确的是( )
A、a管发生吸氧腐蚀,b管发生析氢腐蚀 B、一段时间后,a管液面高于b管液面 C、a处溶液的pH增大,b处溶液的pH减小 D、a、b两处具有相同的电极反应式:Fe-2e-= Fe2+16. 镍镉(Ni-Cd)可充电电池在现代生活中有广泛应用。已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:Cd + 2NiOOH + 2H2O Cd(OH)2 + 2Ni(OH)2 , 有关该电池的说法正确的是( )A、充电时阳极反应:Ni(OH)2 -e- + OH- = NiOOH + H2O B、充电过程是化学能转化为电能的过程 C、放电时负极附近溶液的碱性不变 D、放电时电解质溶液中的OH-向正极移动17. 25℃时pH=13的强碱与pH=2的强酸溶液混合,所得混合液的pH=11,则强碱与强酸的体积比为( )A、9:1 B、1:11 C、1:9 D、11:118. 已知某可逆反应:mA(g)+nB(g) r C(g)在密闭容器中进行。下图表示此反应在不同时间t,温度T和压强p与反应物B在混合气体中的百分含量(B%)的关系曲线。由曲线分析下列判断正确的是( )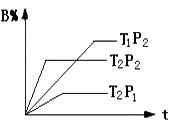 A、T1>T2 , p1>p2 , m+n>r,正反应吸热 B、T1<T2 , p1<p2 , m+n<r,正反应吸热 C、T1>T2 , p1>p2 , m+n<r,正反应放热 D、T1<T2 , p1<p2 , m+n>r,正反应放热19. 下列溶液蒸干后,能析出溶质固体的是( )
A、T1>T2 , p1>p2 , m+n>r,正反应吸热 B、T1<T2 , p1<p2 , m+n<r,正反应吸热 C、T1>T2 , p1>p2 , m+n<r,正反应放热 D、T1<T2 , p1<p2 , m+n>r,正反应放热19. 下列溶液蒸干后,能析出溶质固体的是( )①FeCl3 ②Fe2(SO4)3 ③Ca(HCO3)2 ④Na2CO3
A、仅①④ B、仅②④ C、仅①② D、全部20. 用阳极X和阴极Y电解Z的水溶液,电解一段时间后,再加入W,能使电解液复原的组合是( )X
Y
Z
W
A
C
Fe
NaCl
H2O
B
Pt
Cu
CuSO4
CuSO4溶液
C
C
C
H2SO4
H2O
D
Ag
Fe
AgNO3
AgNO3晶体
A、A B、B C、C D、D21. 有①Na2CO3溶液、②CH3COONa溶液、③NaOH溶液各25mL,物质的量浓度均为0.1mol/L,下列说法正确的是( )A、三种溶液pH的大小顺序是③>②>① B、若将三种溶液稀释相同倍数,pH变化最大的是② C、若分别加入25mL 0.1mol/L盐酸后,pH最大的是① D、若三种溶液的pH均为9,则物质的量浓度的大小顺序是③>①>②二、填空题
-
22. 按要求对下图中两极进行必要的连接并填空:
 (1)、在A图中,使铜片上冒气泡。请加以必要联接,则联接后的装置叫。电极反应式:锌电极:;铜电极:。(2)、在B图中(a,b都为惰性电极),使a极析出铜,则b析出:。加以必要的联接后,该装置叫。电极反应式: b极: 。经过一段时间后,停止反应并搅均溶液,溶液的pH值(升高、降低、不变)。
(1)、在A图中,使铜片上冒气泡。请加以必要联接,则联接后的装置叫。电极反应式:锌电极:;铜电极:。(2)、在B图中(a,b都为惰性电极),使a极析出铜,则b析出:。加以必要的联接后,该装置叫。电极反应式: b极: 。经过一段时间后,停止反应并搅均溶液,溶液的pH值(升高、降低、不变)。三、综合题
-
23. 根据要求回答下列有关问题。(1)、高炉炼铁是冶炼铁的主要方法,发生的主要反应为:Fe2O3(s)+3CO(g) 2Fe(s)+3CO2(g) ∆H=-28.5kJ/mol,冶炼铁反应的平衡常数表达式K= , 温度升高后,K 值(填“增大”、“不变”或“减小”)。(2)、已知:①Fe2O3(s)+3C(石墨) = 2Fe(s)+3CO(g) ∆H1= +489.0kJ/mol
②Fe2O3(s)+3CO(g) 2Fe(s)+3CO2(g) ∆H2= -28.5kJ/mol
③C(石墨)+ CO2(g) = 2CO(g) ∆H3= akJ/mol ,
则a=kJ/mol。
(3)、在T℃时,反应Fe2O3(s)+3CO(g) 2Fe(s)+3CO2(g)的平衡常数K=64,在2L恒容密闭容器中,按下表所示加入物质,经过一段时间后达到平衡。Fe2O3
CO
Fe
CO2
始态mol
1.0
1.0
1.0
1.0
①平衡时CO 的转化率为。
②下列情况标志反应达到平衡状态的是(填字母)。
a.容器内气体密度保持不变
b.容器内气体压强保持不变
c.CO的消耗速率和CO2的生成速率相等
24. 某二元酸H2A在水中的电离方程式是H2A = H+ + HA﹣ , HA﹣ H+ + A2﹣ . 回答下列问题:(1)、Na2A溶液显(填“酸性”、“中性”或“碱性”),理由是(用离子方程式或必要的文字说明).(2)、常温下,已知0.1mol•L﹣1NaHA溶液pH=2,则0.1mol•L﹣1H2A溶液中氢离子的物质的量浓度可能0.11mol•L﹣1(填“大于”、“等于”或“小于”),理由是 .(3)、0.1mol•L﹣1NaHA溶液中各种离子浓度由大到小的顺序是 .(4)、Na2A溶液中,下列表述正确的是_________.A、c(Na+)+ c(H+)= c(HA﹣)+ 2c(A2﹣)+ c(OH﹣) B、c(OH﹣)= c(HA﹣)+ c(H+) C、c(OH﹣)= c(HA﹣)+ c(H+)+ 2c(H2A) D、c (Na+)= 2[c(HA﹣)+ c(A2﹣) + c(H2A)]四、实验题
-
25. 草酸的组成用H2C2O4表示,为了测定某草酸溶液的浓度,进行如下实验:称取Wg草酸晶体,配成100.00mL水溶液,取25.00mL所配制的草酸溶液置于锥形瓶内,加入适量稀H2SO4后,用浓度为amol•L﹣1的KMnO4溶液滴定到KMnO4不再褪色为止,所发生的反应为:2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2↑+2MnSO4+8H2O.
试回答:
(1)、实验中,标准液KMnO4溶液应装在式滴定管中,因为 .(2)、实验中眼睛注视 , 直至滴定终点.判断到达终点的现象是 .(3)、实验中,下列操作(其它操作均正确),会对所测草酸浓度有什么影响?(填偏大、偏小、无影响)A. 滴定前仰视刻度,滴定后俯视刻度 .
B. 锥形瓶在盛放待测液前未干燥,有少量蒸馏水 .
C. 滴定过程中摇动锥形瓶,不慎将瓶内的溶液溅出一部分 .
-