广东省中山市2017-2018学年高二上学期化学期末考试试卷
试卷更新日期:2018-03-19 类型:期末考试
一、单选题
-
1. 绿色能源是指使用过程中不排放或排放极少的污染物的能源,下列能源中不属于绿色能源的是( )A、太阳能 B、化石能源 C、风能 D、潮汐能2. 生产、生活离不开化学,下列说法不正确的是( )A、泡沫灭火器的反应原理是非氧化还原反应 B、钢铁析氢腐蚀和吸氧腐蚀的速率一样快 C、锅炉水垢中含有的CaSO4 , 可先用Na2CO3溶液处理,后用酸除去 D、燃料电池的燃料都在负极发生反应3. 室温下,0.1mol·L-1下列溶液的pH最大的是( )A、Na2SO4 B、NaHCO3 C、NH4Cl D、Na2CO34. 某温度时水的离子积为1×10-12 , 若该温度下某溶液中的H+浓度为1×10-7mol·L-1 , 则该溶液是( )A、酸性 B、碱性 C、中性 D、无法判断5. 下列事实可用勒夏特列原理解释的是( )A、使用催化剂有利于加快合成氨反应的反应速率 B、H2、I2(g)、HI平衡混合气体加压后颜色变深 C、500℃左右比在室温时更有利于提高合成氨的转化率 D、配制氯化铁溶液时,将氯化铁固体溶于浓盐酸中,然后加水稀释6. 下列说法错误的是( )A、S(g)+O2(g)=SO2(g)△H1 S(s)+O2(g)=SO2(g)△H2 , 则△H1<△H2 B、Zn(s)+CuSO4(aq)=ZnSO4(aq)+Cu(s)△H=-261kJ·mol-1 , 则反应总能量>生成物总能量 C、已知C(石墨·s)=C(金刚石·s)△H>0,则石墨比金刚石稳定 D、相同条件下,如果1mol氢原子所具有的能量为E1 , 1mol氢分子所具有的能量为E2 , 则2E1=E27. 将V1mL1.00mol·L-1HCl溶液和V2mL未如浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50mL)。下列叙述正确的是( )
 A、做该实验时环境温度为22℃ B、该实验表明化学能可以转化为热能 C、NaOH溶液的浓度约为1.00mol·L-1 D、该实验表明有水生成的反应都是放热反应8. 室温下将1mol的CuSO4·5H2O(s)溶于水会使溶液温度降低,热效应为△H1 , 将1mol的CuSO4(s)溶于水会使溶液温度升高,热效应为△H2;CuSO4·5H2O受热分解的化学方程式为:CuSO4·5H2O(s)═CuSO4(s)+5H2O(l),热效应为△H3 . 则下列判断正确的是( )A、△H2>△H3 B、△H1>△H3 C、△H1=△H2+△H3 D、△H1+△H2>△H39. 下列判断全部正确的一组是:( )
A、做该实验时环境温度为22℃ B、该实验表明化学能可以转化为热能 C、NaOH溶液的浓度约为1.00mol·L-1 D、该实验表明有水生成的反应都是放热反应8. 室温下将1mol的CuSO4·5H2O(s)溶于水会使溶液温度降低,热效应为△H1 , 将1mol的CuSO4(s)溶于水会使溶液温度升高,热效应为△H2;CuSO4·5H2O受热分解的化学方程式为:CuSO4·5H2O(s)═CuSO4(s)+5H2O(l),热效应为△H3 . 则下列判断正确的是( )A、△H2>△H3 B、△H1>△H3 C、△H1=△H2+△H3 D、△H1+△H2>△H39. 下列判断全部正确的一组是:( )A
B
C
D
强电解质
NaCl
H2SO4
CaF2
石墨
弱电解质
HF
BaSO4
HClO
NH-H2O
非电解质
Cl2
CS2
CCl4
蔗糖
A、A B、B C、C D、D10. 下列事实能说明亚硝酸是弱电解质的是( )①25℃时亚硝酸钠溶液的pH大于7 ②用HNO2溶液做导电试验,灯泡很暗 ③HNO2溶液不与Na2SO4溶液反应 ④0.1mol·L-1HNO2溶液的pH=2.1
A、①②③ B、②③④ C、①④ D、①②④11. 下列叙述正确的是( )A、△H>0的化学反应一定不能自发进行 B、反应2NO2(g) N2O4(l)的熵(体系的混乱度)增大(即△S>0) C、FeCl3和MnO2均可加快H2O2分解,同等条件下二者对H2O2分解速率的改变相同 D、Mg(OH)2固体在溶液中存在平衡:Mg(OH)2(s) Mg2+(aq)+2OH-(aq),该固体可溶于NH4Cl溶液12. 以反应5H2C2O4+2MnO4-+6H+=10CO2↑+2Mn2++8H2O为例探究“外界条件对化学反应速率的影响”。实验时,分别量取H2C2O4溶液和酸性KMnO4溶液,迅速混合并开始计时,通过测定溶液褪色所需时间来判断反应的快慢。编号
H2C2O4溶液
酸性KMnO4溶液
温度/℃
浓度/mol·L-1
体积/mL
浓度/mol·L-1
体积/mL
①
0.10
2.0
0.010
4.0
25
②
0.20
2.0
0.010
4.0
25
③
0.20
2.0
0.010
4.0
50
下列说法不正确的是( )
A、实验①、②、③所加的H2C2O4溶液均要过量 B、实验①测得KMnO4溶液的褪色时间为40s,则这段时间内平均反应速率υ(KMnO4)=2.5×10-4mol·L-1·s-1 C、若生成a L CO2(标准状况),该反应转移的电子数为aNA/22.4 D、实验①和②起初反应均很慢,过了一会儿速率突然增大,可能是生成的Mn2+对反应起催化作用13. 将一定量纯净的氨基甲酸铵置于密闭真空恒容容器中(固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s) 2NH3(g)+CO2(g)。判断该分解反应已经达到化学平衡状态的是( )A、2v(NH3)=v(CO2) B、密闭容器中c(NH3)∶c(CO2)=2∶1 C、密闭容器中混合气体的密度不变 D、密闭容器中氨气的体积分数不变14. 已知A(g)+B(g) C(g)+D(g)反应的平衡常数和温度的关系如下:温度/ ℃
700
800
830
1000
1200
平衡常数
1.7
1.1
1.0
0.6
0.4
830℃时,向一个2 L的密闭容器中充入0.2mol的A和0.8mol的B,反应初始4 s内A的平均反应速率v(A)=0.005mol/(L·s)。下列说法正确的是( )
A、4 s时c(B)为0.76mol/L B、830℃达平衡时,A的转化率为80% C、反应达平衡后,升高温度,平衡正向移动 D、1200℃时反应C(g)+D(g) A(g)+B(g)的平衡常数的值为0.415. 在密闭容器发生下列反应:aA(g) cC(g)+dD(g),反应达到平衡后,将容器体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是( )A、平衡向正反应方向移动 B、a<c+d C、D的体积分数增大 D、A的转化率变大16. 下列四个图像所反映的内容与相应反应符合的是(a、b、c、d均大于0)( )A、 4NH3(g)+5O2(g) 4NO(g)+6H2O(g)ΔH=-akJ·mol-1
B、
4NH3(g)+5O2(g) 4NO(g)+6H2O(g)ΔH=-akJ·mol-1
B、 N2(g)+3H2(g) 2NH3(g)ΔH=-bkJ·mol-1
C、
N2(g)+3H2(g) 2NH3(g)ΔH=-bkJ·mol-1
C、 2SO3(g) 2SO2(g)+O2(g)ΔH=+ckJ·mol-1
D、
2SO3(g) 2SO2(g)+O2(g)ΔH=+ckJ·mol-1
D、 2N2O5(g) 4NO2(g)+O2(g)ΔH=+dkJ·mol-1
17. 利用I2O5可消除CO污染,其反应为:反应为I2O5(s)+5CO(g) 5CO2(g)+I2(s);不同温度下,向装有足量I2O5固体的2 L恒容密闭容器中通入2 mol CO,测得CO2气体体积分数φ(CO2)随时间t变化曲线如图所示。下列说法正确的是( )
2N2O5(g) 4NO2(g)+O2(g)ΔH=+dkJ·mol-1
17. 利用I2O5可消除CO污染,其反应为:反应为I2O5(s)+5CO(g) 5CO2(g)+I2(s);不同温度下,向装有足量I2O5固体的2 L恒容密闭容器中通入2 mol CO,测得CO2气体体积分数φ(CO2)随时间t变化曲线如图所示。下列说法正确的是( ) A、b点时,CO的转化率为20% B、容器内的压强保持恒定,表明反应达到平衡状态 C、b点和d点的化学平衡常数:Kb>Kd D、0到0.5 min反应速率v(CO)=0.3 mol·L-1·min-118. 下列实验不能达到预期实验目的是( )
A、b点时,CO的转化率为20% B、容器内的压强保持恒定,表明反应达到平衡状态 C、b点和d点的化学平衡常数:Kb>Kd D、0到0.5 min反应速率v(CO)=0.3 mol·L-1·min-118. 下列实验不能达到预期实验目的是( )序号
实验内容
实验目的
A
室温下,用pH试纸测定浓度为0.1mol·L-1NaClO溶液和0.1mol·L-1CH3COONa溶液的pH
比较HClO和CH3COOH的酸性强弱
B
向盛有1mL硝酸银溶液的试管中滴加NaCl溶液,至不再有沉淀生成,再向其中滴加Na2S溶液
说明一种沉淀能转化为另一种溶解度更小的沉淀
C
向含有少量FeCl3的MgCl2溶液中加入足量Mg(OH)2粉末,搅拌一会过滤
除去MgCl2中少量FeCl3
D
室温下,分别向2支试管中加入相同体积、相同浓度的Na2S2O3溶液,再分别加入相同体积不同浓度的稀硫酸
研究浓度对反应速率的影响
A、A B、B C、C D、D19. 某学生用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液时,选择甲基橙作指示剂。下列操作中可能使所测NaOH溶液的浓度数值偏低的是( )A、酸式滴定管未用标准盐酸润洗就直接注入标准盐酸 B、滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净后没有干燥 C、酸式滴定管在滴定前有气泡,滴定后气泡消失 D、读取盐酸体积时,开始仰视读数,滴定结束时俯视读数20. 常温下,浓度均为0.1mol/L的三种溶液:①CH3COOH溶液②NaOH溶液③CH3COONa溶液,下列说法中不正确的是(忽略混合前后溶液体积变化)( )A、溶液的pH值:②>③>① B、水电离出的c(OH﹣):③>①>② C、①和②等体积混合后的溶液:c(CH3COOH)+c(CH3COO﹣)=0.1mol/L D、②和③等体积混合后的溶液:c(Na+)+c(H+)=c(OH﹣)+c(CH3COO﹣)21. 室温下向10mL0.1mol•L-1NaOH溶液中加入0.1mol•L-1的一元酸HA溶液pH的变化曲线如图所示。下列说法正确的是( ) A、a点所示溶液中c(Na+)>c(A-)>c(H+)>c(HA) B、a、b两点所示溶液中水的电离程度相同 C、pH=7时,c(Na+)=c(A-)+c(HA) D、b点所示溶液中c(A-)>c(HA)22. 某兴趣小组设计了如图所示原电池装置(盐桥中吸附有饱和K2SO4溶液)。下列说法正确的是( )
A、a点所示溶液中c(Na+)>c(A-)>c(H+)>c(HA) B、a、b两点所示溶液中水的电离程度相同 C、pH=7时,c(Na+)=c(A-)+c(HA) D、b点所示溶液中c(A-)>c(HA)22. 某兴趣小组设计了如图所示原电池装置(盐桥中吸附有饱和K2SO4溶液)。下列说法正确的是( )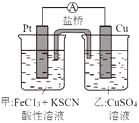 A、该原电池的正极反应是Cu2++2e-=Cu B、甲烧杯中溶液的血红色逐渐变浅 C、盐桥中的SO42-流向甲烧杯 D、若将甲烧杯中的溶液换成稀硝酸,电流表指针反向偏转23. CuI是一种不溶于水的白色固体,它可由反应:2Cu2++4I-=2CuI↓+I2而得到。现用铜片、石墨作电极,电解KI溶液制取CuI。为确认反应情况,通电前在溶液中又加入了少量酚酞试液和淀粉溶液。电解一段时间后得到白色沉淀,同时阴极区溶液变红,阳极区溶液变蓝。下列说法正确的是( )A、铜片做阴极,石墨做阳极 B、白色沉淀在阴极附近生成 C、阳极区溶液变蓝的原因是:2Cu+4I--4e-=2CuI↓+I2 , 碘遇淀粉变蓝 D、阳极区溶液变蓝的原因是:4OH--4e-=2H2O+O2↑,O2将I-氧化为I2 , 碘遇淀粉变蓝24. 亚磷酸(H3PO3)是二元弱酸,亚磷酸主要用作尼龙增白剂,电解Na2HPO3溶液也可得到亚磷酸,装置示意图如图(其中阳膜只允许阳离子通过,阴膜只允许阴离子通过)。下列说法不正确的是( )
A、该原电池的正极反应是Cu2++2e-=Cu B、甲烧杯中溶液的血红色逐渐变浅 C、盐桥中的SO42-流向甲烧杯 D、若将甲烧杯中的溶液换成稀硝酸,电流表指针反向偏转23. CuI是一种不溶于水的白色固体,它可由反应:2Cu2++4I-=2CuI↓+I2而得到。现用铜片、石墨作电极,电解KI溶液制取CuI。为确认反应情况,通电前在溶液中又加入了少量酚酞试液和淀粉溶液。电解一段时间后得到白色沉淀,同时阴极区溶液变红,阳极区溶液变蓝。下列说法正确的是( )A、铜片做阴极,石墨做阳极 B、白色沉淀在阴极附近生成 C、阳极区溶液变蓝的原因是:2Cu+4I--4e-=2CuI↓+I2 , 碘遇淀粉变蓝 D、阳极区溶液变蓝的原因是:4OH--4e-=2H2O+O2↑,O2将I-氧化为I2 , 碘遇淀粉变蓝24. 亚磷酸(H3PO3)是二元弱酸,亚磷酸主要用作尼龙增白剂,电解Na2HPO3溶液也可得到亚磷酸,装置示意图如图(其中阳膜只允许阳离子通过,阴膜只允许阴离子通过)。下列说法不正确的是( ) A、阳极的电极反应式为2H2O-4e-= 4H++O2↑ B、产品室中发生的离子反应为HPO32-+2H+=H3PO3 C、原料室中Na+浓度保持不变 D、阴极室中溶液的pH逐渐升高25. 在t℃时,Ag2CrO4(橘红色)在水溶液中的沉淀溶解平衡曲线如图所示.又知AgCl的Ksp=1.8×10-10。下列说法不正确的是( )
A、阳极的电极反应式为2H2O-4e-= 4H++O2↑ B、产品室中发生的离子反应为HPO32-+2H+=H3PO3 C、原料室中Na+浓度保持不变 D、阴极室中溶液的pH逐渐升高25. 在t℃时,Ag2CrO4(橘红色)在水溶液中的沉淀溶解平衡曲线如图所示.又知AgCl的Ksp=1.8×10-10。下列说法不正确的是( ) A、t℃时,Y点和Z点时Ag2CrO4的Ksp相等 B、饱和Ag2CrO4溶液中加入K2CrO4不能使溶液由Y点变为X点 C、t℃时,Ag2CrO4的Ksp为1×10-8 D、t℃时,将0.01mol·L-1 AgNO3溶液滴入20mL0.01mol·L-1 KCl和0.01mol·L-1 K2CrO4的混合溶液中,Cl-先沉淀
A、t℃时,Y点和Z点时Ag2CrO4的Ksp相等 B、饱和Ag2CrO4溶液中加入K2CrO4不能使溶液由Y点变为X点 C、t℃时,Ag2CrO4的Ksp为1×10-8 D、t℃时,将0.01mol·L-1 AgNO3溶液滴入20mL0.01mol·L-1 KCl和0.01mol·L-1 K2CrO4的混合溶液中,Cl-先沉淀二、综合题
-
26. 根据要求完成下列各小题:(1)、Ⅰ.理论上稀的强酸、强碱反应生成1molH2O(l)时放出57.3kJ的热量,写出表示稀硫酸和稀氢氧化钠溶液反应的中和热的热化学方程式。(2)、已知:乙苯催化脱氢制苯乙烯反应:
 +H2(g)
+H2(g)化学键
C-H
C-C
C=C
H-H
键能/kJ•mol-1
412
348
612
436
计算上述反应的△H=kJ•mol-1。
(3)、Ⅱ.25℃时,部分物质的电离平衡常数如表所示,请回答下列问题:化学式
CH3COOH
H2CO3
HClO
电离平衡常数
1.7×10-5
K1=4.3×10-7
K2=5.6×10-11
3.0×10-8
①CH3COOH、H2CO3、HClO的酸性由强到弱的顺序为。
②将少量CO2气体通入NaClO溶液中,写出反应的离子方程式:。
27. 某合成气的主要成分是一氧化碳和氢气,可用于合成甲醚(CH3OCH3)等清洁燃料。由天然气获得该合成气过程中可能发生的反应有:①CH4(g)+H2O(g) CO(g)+3H2(g) ΔH1=+206.1 kJ·mol-1
②CH4(g)+CO2(g) 2CO(g)+2H2(g) ΔH2=+247.3 kJ·mol-1
③CO(g)+H2O(g) CO2(g)+H2(g) ΔH3
请回答下列问题:
(1)、在一密闭容器中进行反应①,测得CH4的物质的量浓度随反应时间的变化如图所示,则在10 min时,改变的外界条件可能是。 (2)、反应③中ΔH3=。800 ℃时,反应③的平衡常数K=1,测得该温度下密闭容器中某时刻各物质的物质的量见下表:
(2)、反应③中ΔH3=。800 ℃时,反应③的平衡常数K=1,测得该温度下密闭容器中某时刻各物质的物质的量见下表:CO
H2O
CO2
H2
0.5 mol
8.5 mol
2.0 mol
2.0 mol
此时反应③中正、逆反应速率的关系式是(填代号)。
a.v正>v逆 b.v正<逆 c.v正=v逆 d.无法判断
(3)、如图2所示,在甲、乙两容器中分别充入等物质的量的CH4和CO2 , 使甲、乙两容器初始容积相等。在相同温度下发生反应②,并维持反应过程中温度不变。已知甲容器中CH4的转化率随时间的变化如图3所示,请在图3中画出乙容器中CH4的转化率随时间变化的图像。 (4)、某合成气的主要成分中的一氧化碳,在一定条件下也可用NaOH溶液与CO反应生成甲酸钠(HCOONa),进一步反应生成甲酸来消除CO污染。常温下将a mol的CO通入2 L b mol·L-1NaOH溶液中,恰好完全反应生成甲酸钠和含少量甲酸的混合溶液(假设溶液体积不变),测得溶液中c(Na+)=c(HCOO-),则该混合溶液中甲酸的电离平衡常数Ka=(用含a和b的代数式表示)。
(4)、某合成气的主要成分中的一氧化碳,在一定条件下也可用NaOH溶液与CO反应生成甲酸钠(HCOONa),进一步反应生成甲酸来消除CO污染。常温下将a mol的CO通入2 L b mol·L-1NaOH溶液中,恰好完全反应生成甲酸钠和含少量甲酸的混合溶液(假设溶液体积不变),测得溶液中c(Na+)=c(HCOO-),则该混合溶液中甲酸的电离平衡常数Ka=(用含a和b的代数式表示)。三、实验题
-
28. 中华人民共和国国家标准(GB2760-2011)规定葡萄酒中SO2最大使用量为0.25 g·L-1。某兴趣小组用图1装置(夹持装置略)收集某葡萄酒中SO2 , 并对其含量进行测定。
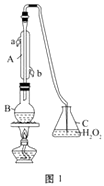
 (1)、仪器A的名称是 , 水通入A的进口为。(2)、B中加入300.00mL葡萄酒和适量盐酸,加热使SO2全部逸出并与C中H2O2完全反应,其化学方程式为。(3)、除去C中过量的H2O2 , 然后用0.090 0 mol·L-1 NaOH标准溶液进行滴定,滴定前排气泡时,应选择图2中的;若滴定终点时溶液的pH=8.8,则选择的指示剂为;若用50 mL滴定管进行实验,当滴定管中的液面在刻度“10”处,则管内液体的体积(填序号)(①=10 mL,②=40 mL,③<10 mL,④>40 mL)。(4)、滴定至终点时,消耗NaOH溶液25.00 mL,该葡萄酒中SO2含量为g·L-1。(5)、该测定结果比实际值偏高,分析原因并利用现有装置提出改进措施:。29. 硼、镁及其化合物在工农业生产中应用广泛。已知:硼镁矿主要成分为Mg2B2O5•H2O,硼砂的化学式为Na2B4O7•10H2O,利用硼镁矿制取金属镁及粗硼的工艺流程如下,请回答下列有关问题:
(1)、仪器A的名称是 , 水通入A的进口为。(2)、B中加入300.00mL葡萄酒和适量盐酸,加热使SO2全部逸出并与C中H2O2完全反应,其化学方程式为。(3)、除去C中过量的H2O2 , 然后用0.090 0 mol·L-1 NaOH标准溶液进行滴定,滴定前排气泡时,应选择图2中的;若滴定终点时溶液的pH=8.8,则选择的指示剂为;若用50 mL滴定管进行实验,当滴定管中的液面在刻度“10”处,则管内液体的体积(填序号)(①=10 mL,②=40 mL,③<10 mL,④>40 mL)。(4)、滴定至终点时,消耗NaOH溶液25.00 mL,该葡萄酒中SO2含量为g·L-1。(5)、该测定结果比实际值偏高,分析原因并利用现有装置提出改进措施:。29. 硼、镁及其化合物在工农业生产中应用广泛。已知:硼镁矿主要成分为Mg2B2O5•H2O,硼砂的化学式为Na2B4O7•10H2O,利用硼镁矿制取金属镁及粗硼的工艺流程如下,请回答下列有关问题: (1)、硼砂中B的化合价为;滤渣的主要成分为。(2)、X为H3BO3晶体加热脱水的产物,其与Mg制取粗硼的化学方程式为。(3)、H3BO3是一种一元弱酸,也可写作B(OH)3 , 它与水作用时结合水电离的OH-而呈酸性,这一变化的离子方程式为。(4)、MgCl2·6H2O需要在HCl氛围中加热,其目的是。(5)、已知25℃时,Ksp[Mg(OH)2]=5.6×10-12;酸碱指示剂百里酚蓝变色的pH范围如下:
(1)、硼砂中B的化合价为;滤渣的主要成分为。(2)、X为H3BO3晶体加热脱水的产物,其与Mg制取粗硼的化学方程式为。(3)、H3BO3是一种一元弱酸,也可写作B(OH)3 , 它与水作用时结合水电离的OH-而呈酸性,这一变化的离子方程式为。(4)、MgCl2·6H2O需要在HCl氛围中加热,其目的是。(5)、已知25℃时,Ksp[Mg(OH)2]=5.6×10-12;酸碱指示剂百里酚蓝变色的pH范围如下:pH
<8.0
8.0~9.6
>9.6
颜色
黄色
绿色
蓝色
在Mg(OH)2饱和溶液中滴加2滴百里酚蓝指示剂,溶液的颜色为。
四、解答题
-
30. SO2、CO、CO2、NOx是对环境影响较大的几种气体,对它们的合理控制和治理是优化我们生存环境的有效途径.
 (1)、利用电化学原理将CO、SO2转化为重要化工原料,装置如图1所示:
(1)、利用电化学原理将CO、SO2转化为重要化工原料,装置如图1所示:①若A为CO,B为H2 , C为CH3OH,则通入CO的为极(填“正”或“负”)。
②若A为SO2 , B为O2 , C为H2SO4 , 则负极的电极反应式为:。
(2)、碳酸盐燃料电池,以一定比例Li2CO3和Na2CO3低熔混合物为电解质,操作温度为650℃,在此温度下以镍为催化剂,以煤气(CO、H2的体积比为1∶1)直接做燃料,其工作原理如图2所示。①电池总反应为。
②以此电源电解足量的硝酸银溶液,若阴极产物的质量为21.6g,电解后溶液体积为2L,溶液的pH约为。
(3)、某研究小组利用下列装置用N2O4生产新型硝化剂N2O5。
①现以H2、O2、熔融盐Na2CO3组成燃料电池,采用电解法制备N2O5 , 装置如图所示,其中Y为CO2。在该电极上同时还引入CO2的目的是。
②电解过程中,生成N2O5的电极反应方程式为。