海南省2015-2016学年九年级化学二模考试试卷
试卷更新日期:2018-03-19 类型:中考模拟
一、单选题
-
1. 下列变化属于化学变化的是 ( )A、海水晒盐 B、干冰制冷 C、切割玻璃 D、燃放烟花2. 学习化学的一个重要途径是科学探究,实验是科学探究的重要手段,下列化学实验操作正确的是( )A、滴加液体
 B、验满氧气
B、验满氧气  C、读取液体体积
C、读取液体体积  D、向试管中加固体
D、向试管中加固体  3. 19世纪60年代,通过对当时发现的63种元素采用科学的分类方法,研制出世界上第一张元素周期表的科学家是( )A、戴维 B、道尔顿 C、门捷列夫 D、阿伏加德罗4. 用分子的观点解释“水变成水蒸气”,下列说法错误的是 ( )A、水分子不停地运动 B、水分子的体积增大 C、水分子的间隔变大 D、水分子本身不发生改变5. 下列实际应用中,与中和反应原理无关的是( )A、用氢氧化钠溶液洗涤石油产品中的残余硫酸 B、用碳酸氢钠治疗胃酸过多 C、用熟石灰改良酸性土壤 D、用稀氨水涂抹在蚊子叮咬处(蚊子能分泌出蚁酸)止痒6. NO2中N元素的化合价为( )A、+2 B、+3 C、+4 D、+57. 为了增强植物抗倒伏的能力,应该施用钾肥。下列化肥属于钾肥的是( )A、碳酸氢铵 B、氯化钾 C、硫酸铵 D、磷矿粉8. 用扇子可以扇灭蜡烛的火焰,其灭火的原理描述正确的是( )A、移走可燃物 B、隔绝空气 C、隔绝氧气 D、降低温度于着火点以下9. 光亮的铁钉在下列几种情况下,最不容易生锈的是( )
3. 19世纪60年代,通过对当时发现的63种元素采用科学的分类方法,研制出世界上第一张元素周期表的科学家是( )A、戴维 B、道尔顿 C、门捷列夫 D、阿伏加德罗4. 用分子的观点解释“水变成水蒸气”,下列说法错误的是 ( )A、水分子不停地运动 B、水分子的体积增大 C、水分子的间隔变大 D、水分子本身不发生改变5. 下列实际应用中,与中和反应原理无关的是( )A、用氢氧化钠溶液洗涤石油产品中的残余硫酸 B、用碳酸氢钠治疗胃酸过多 C、用熟石灰改良酸性土壤 D、用稀氨水涂抹在蚊子叮咬处(蚊子能分泌出蚁酸)止痒6. NO2中N元素的化合价为( )A、+2 B、+3 C、+4 D、+57. 为了增强植物抗倒伏的能力,应该施用钾肥。下列化肥属于钾肥的是( )A、碳酸氢铵 B、氯化钾 C、硫酸铵 D、磷矿粉8. 用扇子可以扇灭蜡烛的火焰,其灭火的原理描述正确的是( )A、移走可燃物 B、隔绝空气 C、隔绝氧气 D、降低温度于着火点以下9. 光亮的铁钉在下列几种情况下,最不容易生锈的是( )
A、 B、
B、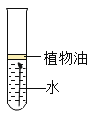 C、
C、 D、
D、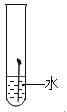 10. 将金属X置于氯化铝溶液中,X表面无固体析出;而将其置于硝酸银溶液中,会发生反应:X + 2AgNO3 = X(NO3)2 + 2Ag。由此可判断X、Al、Ag的金属活动性顺序为( )
10. 将金属X置于氯化铝溶液中,X表面无固体析出;而将其置于硝酸银溶液中,会发生反应:X + 2AgNO3 = X(NO3)2 + 2Ag。由此可判断X、Al、Ag的金属活动性顺序为( )
A、Al>Ag>X B、Ag>X>Al C、Al>X>Ag D、X>Al>Ag11. 四位同学在一起讨论某种物质,请根据他们的讨论判断该物质是( )
A、CH4 B、CO C、C2H5OH D、H212. 日常生活中,区别下列各组物质所用的方法,错误的是( )
A、白酒和白醋——观察颜色 B、棉线和羊毛线——灼烧,闻气味 C、黄铜和黄金——灼烧,观察颜色变化 D、热塑性塑料和热固性塑料——加热,观察外形变化13. 海水淡化可采用膜分离技术。如图所示,对淡化膜右侧的海水加压,水分子可以透过淡化膜进入左侧淡水池,而海水中其他各种离子不能通过淡化膜,从而得到淡水。对加压后右侧海水成分变化分析正确的是( ) A、溶质质量增加 B、溶剂质量减少 C、溶液质量不变 D、溶质质量分数减少14. 下列实验方案能达到目的的是( )
A、溶质质量增加 B、溶剂质量减少 C、溶液质量不变 D、溶质质量分数减少14. 下列实验方案能达到目的的是( )A.探究空气中氧气的含量
B. 探究化学反应是否遵循质量守恒定律
C. 探究可燃物燃烧条件
D.探究影响物质溶解性的因素


 A、A B、B C、C D、D
A、A B、B C、C D、D二、填空题
-
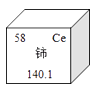
15. 从下列物质选择填空(填序号):①氢气 ②金刚石 ③铜(1)、可用作导线的是;(2)、可用来作燃料的是 ;(3)、可用作钻探钻石头的是。16. 城市中的生活用水是经自来水厂净化处理过的。(1)、水净化过程中,把沉淀物与水分离的操作是(填写操作名称)。(2)、为了检验生活用水是硬水还是软水,可以用来区别。(填一种试剂)17. 碳元素是形成化合物种类最多的元素,含碳物质是中学化学中研究的重要内容。(1)、“低碳”倡导低能量、低消耗,主要是为了减少(填化学式)的排放量。(2)、甲烷(CH4)是天然气的主要成分,甲烷完全燃烧的化学反应方程式是。18. 金属与人类生活密切相关.请分析回答下列问题:(1)、我国稀土储量居世界前列,如图是一种稀土元素铈(Ce)在元素周期表中的信息示意图,则铈原子的质子数是;
 (2)、将黄铜片和纯铜片相互刻画,发现纯铜片表面留下较深的划痕,则它们的硬度大小关系是:黄铜纯铜(填“大于”、“小于”或“等于”);(3)、往AgNO3溶液中加入一定量锌和铜的混合粉末,充分反应后,过滤,滤液为蓝色,则滤液中含有的溶质可能是。19. 实验室中有一瓶标签受损的无色液体,如右图所示。这瓶无色液体是什么呢? 实验员老师告诉大家,该液体只能是过氧化氢溶液、稀硫酸和蒸馏水中的一种。
(2)、将黄铜片和纯铜片相互刻画,发现纯铜片表面留下较深的划痕,则它们的硬度大小关系是:黄铜纯铜(填“大于”、“小于”或“等于”);(3)、往AgNO3溶液中加入一定量锌和铜的混合粉末,充分反应后,过滤,滤液为蓝色,则滤液中含有的溶质可能是。19. 实验室中有一瓶标签受损的无色液体,如右图所示。这瓶无色液体是什么呢? 实验员老师告诉大家,该液体只能是过氧化氢溶液、稀硫酸和蒸馏水中的一种。 (1)、大家讨论后一致认为不可能是蒸馏水,理由是 。(2)、为确定该液体成分,请设计实验方案验证你的猜想。。20. 结合下图所示实验装置回答问题:
(1)、大家讨论后一致认为不可能是蒸馏水,理由是 。(2)、为确定该液体成分,请设计实验方案验证你的猜想。。20. 结合下图所示实验装置回答问题: (1)、检查装置B气密性的方法是。(2)、装置B与C组合,可以制取的一种气体是 , 反应的化学方程式为。21. 配制溶质质量分数一定的氯化钠溶液常有以下操作步奏进行。
(1)、检查装置B气密性的方法是。(2)、装置B与C组合,可以制取的一种气体是 , 反应的化学方程式为。21. 配制溶质质量分数一定的氯化钠溶液常有以下操作步奏进行。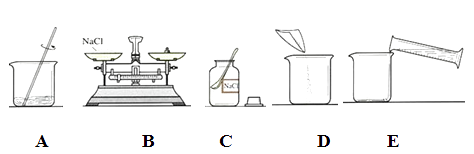
请回答下列问题:
(1)、用上图所示的序号表示正确配制该溶液的操作顺序正确的一组为。①ABCDE ②CBDEA ③BCDAE
(2)、用托盘天平称量所需的氯化钠时,发现托盘天平的指针偏向左盘,应 。A、增加适量氯化钠固体 B、减少适量氯化钠固体 C、调节游码 D、添加砝码(3)、将氯化钠和水依次倒入烧杯中,用玻璃棒搅拌,其目的是 。22. 莽草酸(化学式:C7H10O5)是制取抗“H1N1流感”药物“达菲”的原料。计算:(1)、莽草酸中各元素的质量比为;(2)、莽草酸的相对分子质量为。三、简答题
-
23. 2015年的“地球一小时”(Earth Hour)活动日,主题为““能见蔚蓝”,“能”意味着可再生能源能够带来改变,“蔚蓝”代表我们每个人对告别雾霾、寻回蓝天的期待.为了保护人类赖以生存的空气,我们应采取什么措施(写两点).