备考2018年中考 化学 一轮基础复习:专题二十 常见的酸和碱
试卷更新日期:2018-03-15 类型:一轮复习
一、单选题
-
1. 能使酚酞变红的溶液,一般能使石蕊试液显( )A、红色 B、蓝色 C、紫色 D、无色2. 某溶液能使紫色石蕊溶液变蓝,下列各组离子在该溶液中能大量共存的是( )A、SO42﹣、NO3﹣、Ba2+、Cl﹣ B、Cu2+、Na+、NO3﹣、K+ C、K+、CO32﹣、NO3﹣、Cl﹣ D、H+、Ba2+、K+、NO3﹣3. 一些食物pH 的近似值范围如下:橘子汁3.~4.0;泡菜3.2~3.6;牛奶6.3~6.6;鸡蛋清7.6~8.0.下列说法中,不正确的是( )A、鸡蛋清显碱性 B、胃酸过多的人应少吃泡菜 C、橘子汁能使紫色石蕊溶液变红 D、牛奶比橘子汁的酸性强4. 下列实验现象描述正确的是( )A、向硫酸铜溶液中滴加氢氧化钠溶液,有白色沉淀生成 B、将二氧化碳通入紫色石蕊溶液中,溶液变蓝 C、硫在氧气中燃烧,发出蓝紫色火焰 D、打开盛有浓盐酸的试剂瓶的瓶塞,瓶口冒白烟5. 将一定质量的铁粉和氧化铜粉末投入到一定质量的稀硫酸中,充分反应后过滤,得到滤液M和滤渣N,下列有关说法:
①滤液M中一定含有硫酸铁,可能含有硫酸和硫酸铜;
②在滤液M中放入一块刚打磨过的锌片,一定有置换反应发生;
③向滤渣N中滴加稀硫酸.可能有气泡产生;
④当滤液M中含有硫酸铜时,滤渣N中一定没有氧化铜
其中一定正确的说法是( )
A、①② B、②③ C、③④ D、①④6. 下列图象能正确反映其对应操作中各量变化关系的是( ) A、图①是给氯酸钾和二氧化锰的混合物加热 B、图②是向一定温度下的饱和氢氧化钙溶液中不断加入氧化钙固体 C、图③是向pH=1的酸溶液中不断加水 D、图④是向一定质量的稀硫酸中加入锌粒7. 某黑色固体粉末可能是Fe、FeO、CuO和C中的一种或几种.取黑色粉末,加入一定量的稀硫酸,待充分反应后过滤,得到滤液和滤渣,在滤液中插入一根洁净的铁丝.有关说法正确的是( )A、若滤液呈浅绿色,则原黑色固体粉末中一定有Fe B、若铁丝表面只有红色固体析出,则滤渣中一定无CuO C、若铁丝表面无明显现象,则滤渣中最多有四种物质 D、若铁丝表面只有气泡产生,则滤液中溶质一定有H2SO4和FeSO48. 下列叙述正确的是( )A、用小苏打治疗胃酸过多 B、用氢氧化钠改良酸性土壤 C、用铁桶长时间存放硫酸铜溶液 D、用食盐水除去热水瓶中的水垢9. 分析推理是化学学习中常用的思维方法,下列分析推理正确的是( )A、碱溶液pH大于7,所以pH大于7的溶液一定是碱溶液 B、酸和碱作用生成盐和水的反应是中和反应,所以生成盐和水的反应一定是中和反应 C、离子是带电荷的粒子,所以带电荷的粒子一定是离子 D、单质是由同种元素组成的,所以由同种元素组成的纯净物一定是单质10. 已知氢氧化锂(LiOH)可溶于水,其化学性质与氢氧化钠相似。下列对氢氧化锂的化学性质的说法中错误的是( )
A、图①是给氯酸钾和二氧化锰的混合物加热 B、图②是向一定温度下的饱和氢氧化钙溶液中不断加入氧化钙固体 C、图③是向pH=1的酸溶液中不断加水 D、图④是向一定质量的稀硫酸中加入锌粒7. 某黑色固体粉末可能是Fe、FeO、CuO和C中的一种或几种.取黑色粉末,加入一定量的稀硫酸,待充分反应后过滤,得到滤液和滤渣,在滤液中插入一根洁净的铁丝.有关说法正确的是( )A、若滤液呈浅绿色,则原黑色固体粉末中一定有Fe B、若铁丝表面只有红色固体析出,则滤渣中一定无CuO C、若铁丝表面无明显现象,则滤渣中最多有四种物质 D、若铁丝表面只有气泡产生,则滤液中溶质一定有H2SO4和FeSO48. 下列叙述正确的是( )A、用小苏打治疗胃酸过多 B、用氢氧化钠改良酸性土壤 C、用铁桶长时间存放硫酸铜溶液 D、用食盐水除去热水瓶中的水垢9. 分析推理是化学学习中常用的思维方法,下列分析推理正确的是( )A、碱溶液pH大于7,所以pH大于7的溶液一定是碱溶液 B、酸和碱作用生成盐和水的反应是中和反应,所以生成盐和水的反应一定是中和反应 C、离子是带电荷的粒子,所以带电荷的粒子一定是离子 D、单质是由同种元素组成的,所以由同种元素组成的纯净物一定是单质10. 已知氢氧化锂(LiOH)可溶于水,其化学性质与氢氧化钠相似。下列对氢氧化锂的化学性质的说法中错误的是( )
A、能与二氧化碳反应 B、能使无色酚酞溶液变红 C、能使紫色石蕊溶液变红 D、能与稀硫酸反应二、填空题
-
11.
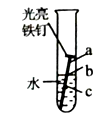
如图所示,铁钉最容易生锈的是处(填“a”、“b”或“c”),常用稀硫酸除去铁锈,写出该反应的化学方程式: .
 12. 某同学做实验时发现,盛放NaOH溶液的瓶口与橡皮塞上,常有白色粉末出现.为探究这种白色粉末的成分,设计了如下实验.请你完成实验报告.
12. 某同学做实验时发现,盛放NaOH溶液的瓶口与橡皮塞上,常有白色粉末出现.为探究这种白色粉末的成分,设计了如下实验.请你完成实验报告.实验步骤
实验现象
结论和反应的化学方程式
1)、
白色粉末溶于水,形成无色溶液.
/
2)、

酚酞变红.
溶液呈碱性,含有离子.
3)、
溶液由红色变为无色,并有气泡产生.产生的气体能使燃着的木条熄灭.
溶液中含有 .
白色粉末中有氢氧化钠变质生成的产生气体的方程式为
该实验证明氢氧化钠已经变质,有关方程式 .
三、综合题
-
13. 分析下列图象,按要求回答问题:
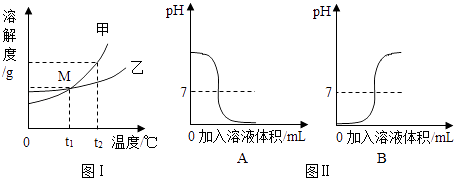 (1)、图Ⅰ中M点表示的意义是;甲、乙两物质的溶解度受温度影响较大的是 .(2)、图Ⅱ是中和反应过程中溶液pH值变化的图象,其中能表示向氢氧化钠溶液中滴加稀盐酸的是(填“A”或“B”),若在氢氧化钠溶液中预先滴加酚酞试液,则在滴加稀盐酸的过程中溶液颜色的变化为 .14. 载人航天器工作舱中的空气要与地球上的空气基本一致.
(1)、图Ⅰ中M点表示的意义是;甲、乙两物质的溶解度受温度影响较大的是 .(2)、图Ⅱ是中和反应过程中溶液pH值变化的图象,其中能表示向氢氧化钠溶液中滴加稀盐酸的是(填“A”或“B”),若在氢氧化钠溶液中预先滴加酚酞试液,则在滴加稀盐酸的过程中溶液颜色的变化为 .14. 载人航天器工作舱中的空气要与地球上的空气基本一致.资料:在同温同压下,气体的体积之比等于分子个数之比.
(1)、用微观示意图表示工作舱中空气的主要成分,下图中最合理的是(填序号). (2)、宇航员呼出的CO2用氢氧化锂(LiOH)吸收,生成Li2CO3和H2O,反应的化学方程式为(3)、航天器返回地面后,用Ca(OH)2与Li2CO3发生复分解反应,使(填化学式)再生.15. 某种矿石由氧化镁、氧化铁、氧化铜和二氧化硅组成,用它制备氢氧化镁的流程示意图如图所示(已知:二氧化硅不溶于水也不与稀盐酸反应).
(2)、宇航员呼出的CO2用氢氧化锂(LiOH)吸收,生成Li2CO3和H2O,反应的化学方程式为(3)、航天器返回地面后,用Ca(OH)2与Li2CO3发生复分解反应,使(填化学式)再生.15. 某种矿石由氧化镁、氧化铁、氧化铜和二氧化硅组成,用它制备氢氧化镁的流程示意图如图所示(已知:二氧化硅不溶于水也不与稀盐酸反应).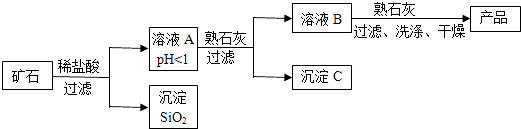
请回答下列问题:
(1)、溶液A中共含有种阳离子;写出矿石中的任意一种金属氧化物与稀盐酸反应的化学方程式(只写一个)(2)、在溶液A中加入熟石灰调节溶液的pH,可以使溶液中的金属阳离子转化为沉淀,该实验条件下,使金属阳离子沉淀的相关pH数据见表.为保证产品纯度、减少产品损失,并便于操作,溶液B的pH可允许的范围为是;氢氧化物
Fe(OH)3
Cu(OH)2
Mg(OH)2
开始沉淀的pH
1.5
4.2
8.6
完全沉淀的pH
3.2
6.7
11.1
(3)、写出溶液B中加入熟石灰发生的化学反应方程式 .