备考2018年高考化学二轮专题复习 总结复习:化学计算
试卷更新日期:2018-06-11 类型:
一、单选题
-
1. 设NA为阿伏加德罗常数的数值,下列说法正确的是( )A、1L0.1 mol•L﹣1的氨水中含有0.1NA个OH﹣ B、78gNa2O2固体中含有的阴离子数目为2NA C、常温下,23gNO2和N2O4的混合气体含有NA个氧原子 D、常温下,4gCH4中含有4NA个C﹣H共价键2. NA为阿伏加德罗常数,下列叙述不正确的是( )A、标准状况下,22.4 L的CCl4中所含质子数为74 NA B、2 mol SO2和1 mol O2在一定条件下充分反应后,所得混合气体的分子数大于2NA C、12 g石墨晶体中含有的碳碳键数目为1.5 NA D、分子数为0.1NA的N2和NH3混合气体,原子间含有的共用电子对数目为0.3NA3. 某同学在家自制“84消毒液”,他根据84消毒液标签上的配方,用NaClO固体配制480mL质量分数为25%的、密度为1.19g/cm3的NaClO消毒液.下列说法正确的是( )A、容量瓶用蒸馏水洗净后需晾干才能使用 B、需称取NaClO固体144g C、所配得NaClO消毒液久置后会失效 D、8 4消毒液的消毒原理是利用了NaClO的强碱性4. 在T℃ 时,将a g NH3完全溶于水,得到V mL溶液,假设该溶液的密度为ρ g•cm﹣3 , 溶质的质量分数为w,其中含NH3的物质的量为b mol.下列叙述中正确的是( )A、溶质的质量分数为w= ×100% B、溶质的物质的量浓度c= mol•L﹣1 C、溶液中c(OH﹣)= mol•L﹣1 D、上述溶液中再加入V mL水后,所得溶液溶质的质量分数大于0.5w5. 相对分子质量为a的某物质在室温下的溶解度为bg,此时测得饱和溶液的密度为c g•cm﹣3 , 则该饱和溶液的物质的量浓度是( )A、 mol•L﹣1 B、 mol•L﹣1 C、 mol•L﹣1 D、 mol•L﹣16. 用NA表示阿伏加德罗常数的值,下列叙述正确的是( )A、2.0gH218O与D216O的混合物中所含中子数为NA B、0.1molCl2溶于足量水中,转移的电子数为0.1NA C、常温常压下50g 46%的乙醇溶液中,所含氧原子数目为0.5NA D、25℃时,pH=13的Ba(OH)2溶液中含有的OH﹣数目为0.1NA7. 设NA为阿伏加德罗常数的值,下列有关叙述正确的是( )A、28g乙烯所含共用电子对数目为4NA B、0.5mol 1,3﹣丁二烯分子中含有C=C双键数为NA C、1 mol羟基所含的电子总数为10NA D、标准状况下,11.2 L己烷所含分子数为0.5NA8. 设阿伏加德罗常数的值为NA , 下列说法中正确的是( )A、17 g甲基(﹣14CH3)所含中子数为9 NA B、常温常压下,2.8 g乙烯和丙烯的混合气体中所含碳原子数为0.2 NA C、0.1 mol C5H12分子中含有的C﹣C键数为0.5 NA D、标准状况下,2.24 L辛烷在氧气中完全燃烧生成CO2分子数为0.8 NA9. NA为阿伏加德罗常数,下列说法正确的是( )A、标准状况下,11.2L的戊烷所含的分子数为0.5NA B、28g乙烯所含共用电子对数目为4NA C、现有乙烯、丙烯、丁烯的混合气体共14g,其原子数为3NA D、标准状况下,11.2 L二氯甲烷所含分子数为0.5 NA10. 3g镁铝合金与100mL稀硫酸恰好完全反应,将反应后的溶液加热蒸干,得到无水硫酸盐17.4g,则原硫酸的物质的量浓度为( )A、1mol•L﹣1 B、1.5mol•L﹣1 C、2mol•L﹣1 D、2.5mol•L﹣111. 有K2SO4和Al2(SO4)3的混合溶液,已知其中Al3+的物质的量浓度为0.4mol•L﹣1 , SO42﹣的物质的量浓度为0.7mol•L﹣1 , 则此溶液中K+的物质的量浓度为( )A、0.1 mol•L﹣1 B、0.15 mol•L﹣1 C、0.2 mol•L﹣1 D、0.25 mol•L﹣112. 把200mL含有BaCl2和KCl的混合溶液分成2等份,取一份加入含a mol硫酸钠的溶液,恰好使钡离子完全沉淀,另取一份加入含b mol硝酸银的溶液恰好使氯离子完全沉淀.则该混合溶液中钾离子浓度为( )A、0.1(b﹣2a) mol•L﹣1 B、10(2a﹣b) mol•L﹣1 C、10(b﹣a) mol•L﹣1 D、10(b﹣2a) mol•L﹣113. 把V L含有MgSO4和K2SO4的混合溶液分成两等份,一份加入含a mol NaOH的溶液,恰好使镁离子完全沉淀为氢氧化镁;另一份加入含b mol BaCl2的溶液,恰好使硫酸根离子完全沉淀为硫酸钡.则原混合溶液中钾离子的浓度为( )A、 mol•L﹣1 B、 mol•L﹣1 C、 mol•L﹣1 D、 mol•L﹣114. 将由a mol NaHCO3和b mol NaOH组成的固体混合物放在密闭容器中加热到250℃,经充分反应后,排出气体,冷却后,称量残留固体的质量为W g,试计算W的值可能为( )
①84a+40b ②53a+40b ③66a+40b ④53(a+b)
A、①② B、②④ C、只有④ D、③④二、多选题
-
15. 设NA为阿伏加德罗常数的值,下列有关叙述正确的是( )A、28g乙烯所含共用电子对数目为4NA B、1mol C4H10分子中共价键总数为13NA C、1 mol甲基所含的电子总数为9NA D、标准状况下,11.2 L己烷所含分子数为0.5 NA
三、综合题
-
16. 往100mL的NaOH溶液中通入CO2充分反应后,在减压和较低温度下,小心地将溶液蒸干,得到白色固体M.通入的CO2的体积(标准状况)与M的质量的关系如图所示.
试回答下列问题:
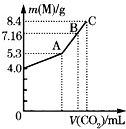 (1)、A点时,白色固体M的化学式为 , 通入的CO2的体积为 mL(标准状况下,下同).(2)、C点时,白色固体M的化学式为 , 通入的CO2的体积为 mL.(3)、B点时M的组成成分为(用化学式表示),通入的CO2的体积为 mL.(4)、该NaOH溶液的物质的量浓度为 .17. 取NaHCO3和Na2O2的固体混合物x g放入一密闭容器中加热至250℃,充分反应后排出所有气体.将反应后的固体分成完全相同的两份,将其中一份投入到足量的BaCl2溶液中,最后可得到3.94g沉淀.另一份溶于适量的水,无气体放出,再向水溶液中缓慢逐滴加入某物质的量浓度的盐酸,产生气体与所加盐酸体积之间的关系如图所示.试回答下列问题:
(1)、A点时,白色固体M的化学式为 , 通入的CO2的体积为 mL(标准状况下,下同).(2)、C点时,白色固体M的化学式为 , 通入的CO2的体积为 mL.(3)、B点时M的组成成分为(用化学式表示),通入的CO2的体积为 mL.(4)、该NaOH溶液的物质的量浓度为 .17. 取NaHCO3和Na2O2的固体混合物x g放入一密闭容器中加热至250℃,充分反应后排出所有气体.将反应后的固体分成完全相同的两份,将其中一份投入到足量的BaCl2溶液中,最后可得到3.94g沉淀.另一份溶于适量的水,无气体放出,再向水溶液中缓慢逐滴加入某物质的量浓度的盐酸,产生气体与所加盐酸体积之间的关系如图所示.试回答下列问题: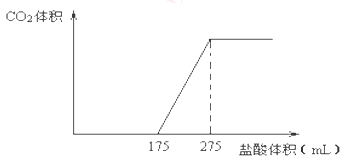 (1)、加入盐酸后总共产生的气体在标准状况下的体积为 L;(2)、盐酸中HCl的物质的量浓度;(3)、反应后的固体的成分(填化学式);(4)、x= .
(1)、加入盐酸后总共产生的气体在标准状况下的体积为 L;(2)、盐酸中HCl的物质的量浓度;(3)、反应后的固体的成分(填化学式);(4)、x= .
-