备考2018年高考化学二轮专题复习 专题15:无机化工流程题
试卷更新日期:2018-03-15 类型:二轮复习
一、综合题
-
1. 化工原料红矾钠(重铬酸钠:Na2Cr2O7•2H2O)主要是以铬铁矿(主要成分为 FeO•Cr2O3 , 还含有Al2O3、SiO2 等杂质)为主要原料生产,其主要工艺流程如下(如图1):
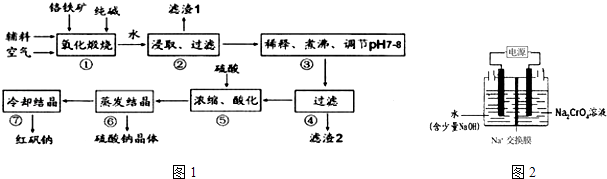
步骤①中主要反应的化学方程式为:4FeO•Cr2O3+8Na2CO3+7O2=8Na2CrO4+2Fe2O3+8CO2
(1)、杂质 Al2O3、SiO2在①中转化后经加水过滤进入滤液,写出Al2O3在①中转化的化学反应方程式 .(2)、用化学平衡移动原理说明③中煮沸的作用是(用离子方程式结合文字说明)(3)、⑤中酸化是使 CrO42-转化为 Cr2O72- , 若1L酸化后所得溶液中含铬元素的质量为 28.6g,CrO42﹣有 转化为 Cr2O72﹣ .①酸化后所得溶液中 c(Cr2O72﹣ )=
②工业上也可设计图2示装置(两极均为惰性电极)电解Na2CrO4溶液制取 Na2Cr2O7 , 图2中右侧电极的电极反应式为 . 若电解前两侧溶液的质量相等,则当电解过程中转移了1mol 电子时两侧溶液的质量差为g.
2. 钨是我国丰产元素,是熔点最高的金属,广泛用于拉制灯泡的灯丝,钨在自然界主要以钨(VI) 酸盐的形式存在.有开采价值的钨矿石之一白钨矿的主要成分是CaWO4 , 含有二氧化硅、氧化铁等杂质,工业冶炼钨流程如下: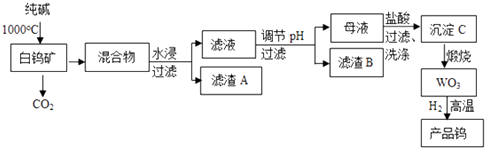
已知:
①钨酸酸性很弱,难溶于水
②完全沉淀离子的pH值: 为8, 为5
③碳和金属钨在高温下会反应生成碳化钨
(1)、74W在周期表的位置是第周期.(2)、CaWO4与纯碱发生的化学反应方程式是 .(3)、滤渣B的主要成分是(写化学式) . 调节pH可选用的试剂是:(填写字母序号).A.氨水 B.氢氧化钠溶液 C.盐酸 D.碳酸钠溶液
(4)、母液中加入盐酸的离子方程式为 . 检验沉淀C是否洗涤干净的操作是 .(5)、为了获得可以拉制灯丝的高纯度金属钨,不宜用碳而必须用氢气作还原剂的原因是 .(6)、将氢氧化钙加入钨酸钠碱性溶液中可得到钨酸钙,已知温度为T时Ksp(CaWO4)=1×10﹣10 , Ksp[Ca(OH)2]=4×10﹣7 , 当溶液中 恰好沉淀完全 (离子浓度等于10﹣5mol/L)时,溶液中 = .3. 锰酸锂(LiMn2O4)可作为锂离子电池的正极材料.工业上利用软锰矿浆吸收含硫烟气(SO2 和O2)制备锰酸锂,生产流程如图1:
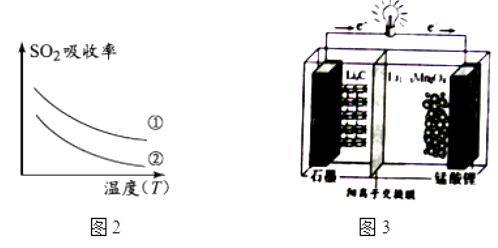
已知:①软锰矿主要成分为MnO2 , 含少量Fe2O3、FeO、Al2O3、SiO2等杂质.
②软锰矿浆在吸收含硫烟气的过程中酸性逐渐增强.
③部分氢氧化物沉淀相关的溶液pH如表一:
沉淀物
Fe(OH)3
Fe(OH)2
Al(OH)3
Mn(OH)2
开始沉淀
2.7
7.6
3.4
7.7
完全沉淀
3.7
9.6
4.7
9.8
(1)、已知:(图2)表二表二
实验序号
SO2浓度(g•m﹣3)
烟气流速(mL•min﹣1)
①
4.1
55
②
4.1
96
下列措施可提高SO2吸收率的是(填序号)
a.降低通入含硫烟气的温度 b.升高通入含硫烟气的温度
c.减少软锰矿浆的进入量 d.减小通入含硫烟气的流速
(2)、加入试剂X能提高产品纯度,则X可以是(填化学式)(3)、加氨水调溶液pH在5~6之间,目的是 .(4)、锰酸锂可充电电池(图3)的总反应式为:Li1﹣xMnO4+LixC LiMnO4+C(x<1)①放电时,电池的正极反应式为
②充电时,若转移1mole﹣ , 则石墨电极将增重g.
4. 锌是一种应用广泛的金属,目前工业上主要采用“湿法”工艺冶炼锌.某硫化锌精矿的主要成分为ZnS(还含少量FeS等其他成分),以其为原料冶炼锌的工艺流程如图所示:
回答下列问题:
(1)、硫化锌精矿的焙烧在氧气气氛的沸腾炉中进行,所产生焙砂的主要成分的化学式为 .(2)、焙烧过程中产生的含尘烟气可净化制酸,该酸可用于后续的操作.(3)、浸出液“净化”过程中加入的主要物质为 , 其作用是 .(4)、电解沉积过程中的阴极采用铝板,阳极采用Pb﹣Ag合金惰性电极,阳极逸出的气是 .(5)、改进的锌冶炼工艺,采用了“氧压酸浸”的全湿法流程,既省略了易导致空气污染的焙烧过程,又可获得一种有工业价值的非金属单质.“氧压酸浸”中发生主要反应的离子方程式为 .(6)、硫化锌精矿(ZnS)遇到硫酸铜溶液可慢慢地转变为铜蓝(CuS).请用简短的语言解释该反应发生的原理 .(7)、我国古代曾采用“火法”工艺冶炼锌,明代宋应星著的《天工开物》中有关于“升炼倭铅”的记载:“炉甘石十斤,装载入一泥罐内,…,然后逐层用煤炭饼垫盛,其底铺薪,发火煅红,…,冷淀,毁罐取出,…,即倭铅也.”该炼锌工艺过程主要反应的化学方程式为 . (注:炉甘石的主要成分为碳酸锌,倭铅是指金属锌)5. 工业废水中含有流失的生产用料、中间产物和产品,以及生产过程中产生的污染物.随着工业的迅速发展,废水的排放量迅速增加,严重威胁人类的健康和安全,工业废水的处理比城市污水的处理更为重要.图是含铬工业废水和含氰废水的处理流程:
请回答下列问题:
(1)、电镀废水中的铬主要以CrO42﹣形式存在,其中Cr元素的化合价为 .(2)、酸性条件下,CrO42﹣极易被还原剂还原为毒性较小的Cr3+ . 图中“反应Ⅰ”的离子方程式为 .(3)、pH>10时,“反应Ⅱ”中的NaClO可快速地将氰离子(CN﹣)氧化为无毒的两种物质,这两种物质是、(写化学式);若pH<8.5,则生成剧毒的CNCl气体(沸点13.1℃),写出该反应的离子方程式 .(4)、经过“反应Ⅰ”和“反应Ⅱ”将两种废水混合的目的是 .(5)、含氰废水及含铬废水可以通过电化学的方法进行无害化处理.①可采用惰性电极对含氰废水进行电解,氰离子在碱性条件下被氧化为无毒的物质,该电解工艺中,阳极电极反应是 .
②电解法处理酸性含铬废水(若铬元素以Cr2O72﹣形式存在)时,以铁板和石墨作电极,处理过程中存在反应Cr2O72﹣+6Fe2++14H+=2Cr3++6Fe3++7H2O.则阳极的电极反应式为 , 当有1mol Cr2O72﹣被还原时,电路中转移的电子为mol.
6. 铝是应用广泛的金属.以铝土矿(主要成分为Al2O3 , 含SiO2和Fe2O3等杂质)为原料制备铝的一种工艺流程如下: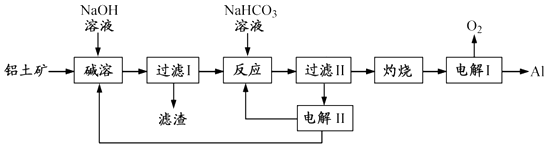
注:SiO2在“碱溶”时转化为铝硅酸钠沉淀.
(1)、“碱溶”时生成偏铝酸钠的离子方程式为 .(2)、向“过滤Ⅰ”所得滤液中加入NaHCO3溶液,溶液的pH (填“增大”、“不变”或“减小”).(3)、“电解Ⅰ”是电解熔融 Al2O3 , 电解过程中作阳极的石墨易消耗,原因是 .(4)、“电解Ⅱ”是电解Na2CO3溶液,原理如图所示.
阳极的电极反应式为 , 阴极产生的物质A的化学式为 .
(5)、铝粉在1000℃时可与N2反应制备AlN.在铝粉中添加少量NH4Cl固体并充分混合,有利于AlN的制备,其主要原因是 .7.七铝十二钙 (12CaO·7Al2O3)是一种新型的超导材料和发光材料,它是用一定量的CaCO3溶解于酸性AlCl3溶液,再用氨水沉淀,然后煅烧沉淀制备。工业上制备七铝十二钙的流程如下图:
 (1)、轻烧后产生的AlCl3蒸气易凝华,为防止堵塞导气管可采取的措施为。(2)、吸收时用稀盐酸溶解的原因是。(3)、AlCl3溶液溶解CaCO3时,要控制碳酸钙和AlCl3的量,要求n(CaCO3)∶n(AlCl3)> 12∶14,其原因是。但若加入CaCO3过多,会产生的后果是。(4)、沉淀、过滤后的滤液主要成分是。(5)、以工业碳酸钙(含有少量Al2O3、Fe3O4杂质)生产二水合氯化钙(CaCl2·2H2O)的方法为:将工业碳酸钙溶于盐酸,加入双氧水, , 冰水洗涤,干燥,得到CaCl2·2H2O(实验中需用到的试剂和仪器有:盐酸,双氧水,氢氧化钙,冰水,pH计)。
(1)、轻烧后产生的AlCl3蒸气易凝华,为防止堵塞导气管可采取的措施为。(2)、吸收时用稀盐酸溶解的原因是。(3)、AlCl3溶液溶解CaCO3时,要控制碳酸钙和AlCl3的量,要求n(CaCO3)∶n(AlCl3)> 12∶14,其原因是。但若加入CaCO3过多,会产生的后果是。(4)、沉淀、过滤后的滤液主要成分是。(5)、以工业碳酸钙(含有少量Al2O3、Fe3O4杂质)生产二水合氯化钙(CaCl2·2H2O)的方法为:将工业碳酸钙溶于盐酸,加入双氧水, , 冰水洗涤,干燥,得到CaCl2·2H2O(实验中需用到的试剂和仪器有:盐酸,双氧水,氢氧化钙,冰水,pH计)。已知:几种离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol/L计算):
开始沉淀的pH
完全沉淀的pH
Fe3+
1.1
3.2
Al3+
3.5
4.7
8. 某厂的酸性工业废水中含有一定量的Fe3+、Cu2+、Au3+等离子,有人设计了图中的工艺流程,从废水中回收金,并生产一定量的铁红和氧化铜(图中标号处只利用工业生产中的常用的酸、碱和废铁屑).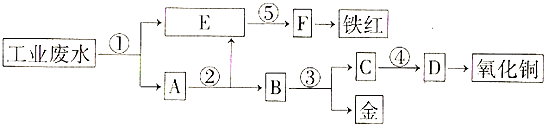 (1)、图中标号处需加入的相应物质分别是①、②、③、④、⑤;(2)、写出①处所有可能发生的离子方程式(3)、写出③处发生反应的化学方程式;(4)、铁红的化学式为;写出铁红在工业上的一种主要用途 .9.
(1)、图中标号处需加入的相应物质分别是①、②、③、④、⑤;(2)、写出①处所有可能发生的离子方程式(3)、写出③处发生反应的化学方程式;(4)、铁红的化学式为;写出铁红在工业上的一种主要用途 .9.以磷石膏(只要成分CaSO4 , 杂质SiO2、Al2O3等)为原料可制备轻质CaCO3
 (1)、
(1)、- 匀速向浆料中通入CO2 , 浆料清液的pH和c(SO42-)随时间变化见由右图。清液pH>11时CaSO4转化的离子方程式 ;能提高其转化速率的措施有 (填序号)
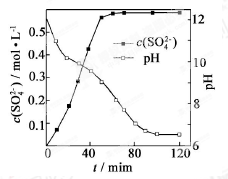
- A.搅拌浆料 B.加热浆料至100℃
- C.增大氨水浓度 D.减小CO2通入速率
(2)、当清液pH接近6.5时,过滤并洗涤固体。滤液中物质的量浓度最大的两种阴离子为 和 (填化学式);检验洗涤是否完全的方法是 。(3)、在敞口容器中,用NH4Cl溶液浸取高温煅烧的固体,随着浸取液温度上升,溶液中c(Ca2+)增大的原因 。10.二氧化铈(CeO2)是一种重要的稀土氧化物。平板电视显示屏生产过程中产生大量的废玻 璃粉末(含SiO2、Fe2O3、CeO2等物质)。某课题小组以此粉末为原料,设计资源回收的工艺流程如下:
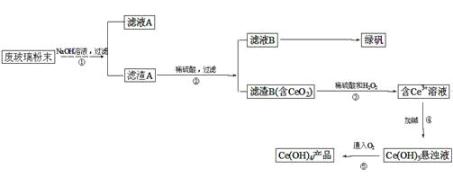 (1)、写出第①步反应的离子方程式。(2)、洗涤滤渣B的目的是为了除去(填离子符号),检验该离子是否洗净的方法是。(3)、写出第③步反应的化学方程式。(4)、制备绿矾(FeSO4·7H2O)时,向Fe2(SO4)3溶液中加入过量铁屑,充分反应后,经过滤得到FeSO4溶液,再经、、过滤、洗涤、干燥等操作步骤得到绿矾。(5)、取上述流程中得到的Ce(OH)4产品(质量分数为86%)1.000g,加硫酸溶解后,用0.1000mol/L FeSO4溶液滴定至终点(铈被还原成Ce3+),则需准确滴加标准溶液的体积为mL。11. 钛被称为“二十一世纪金属”,工业上用钛铁矿制备金属钛的工艺流程如下:
(1)、写出第①步反应的离子方程式。(2)、洗涤滤渣B的目的是为了除去(填离子符号),检验该离子是否洗净的方法是。(3)、写出第③步反应的化学方程式。(4)、制备绿矾(FeSO4·7H2O)时,向Fe2(SO4)3溶液中加入过量铁屑,充分反应后,经过滤得到FeSO4溶液,再经、、过滤、洗涤、干燥等操作步骤得到绿矾。(5)、取上述流程中得到的Ce(OH)4产品(质量分数为86%)1.000g,加硫酸溶解后,用0.1000mol/L FeSO4溶液滴定至终点(铈被还原成Ce3+),则需准确滴加标准溶液的体积为mL。11. 钛被称为“二十一世纪金属”,工业上用钛铁矿制备金属钛的工艺流程如下: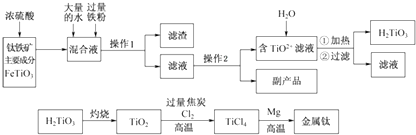
已知:钛铁矿主要成分与浓硫酸反应的主要产物是TiOSO4和FeSO4 , TiOSO4遇水会水解.
请回答下列问题:
(1)、操作1用到的玻璃仪器除烧杯外还有 , 操作2是、过滤,副产品主要成分的化学式为(2)、请结合化学用语解释将TiO2+转化为H2TiO3的原理(3)、已知钛的还原性介于铝和锌之间,估计钛能耐腐蚀的原因之一是 , 如果可从Za、Zn、Fe三种金属中选一种金属代替流程中的镁,那么该金属跟四氯化钛反应的化学方程式是(4)、电解TiO2来获得Ti是以TiO2作阴极,石墨为阳极,熔融CaO为电解质,用碳块作电解槽,其阴极反应的电极反应式为(5)、为测定溶液中TiOSO4的含量,首先取待测钛液10mL用水稀释至100mL,加过量铝粉,充分振荡,使其完全反应:3TiO2++Al+6H+═3Ti3++AlO3++3H2O,过过滤后,取出滤液20.00mL,向其中滴加2~3滴KSCN溶液作指示剂,用(填一种玻璃仪器的名称)滴加0.1000mol•L﹣1FeCl3溶液,发生Ti3++Fe3+═Ti4++Fe2+ , 当溶液出现红色达到滴定终点,用去了30.00mLFeCl3溶液,待测钛液中TiOSO4的物质的量浓度是 .12. 废弃物的综合利用既有利于节约资源,又有利于保护环境.实验室利用废旧黄铜(Cu、Zn合金,含少量杂质Fe)制备胆矾晶体(CuSO4•5H2O)及副产物ZnO.制备流程图如下: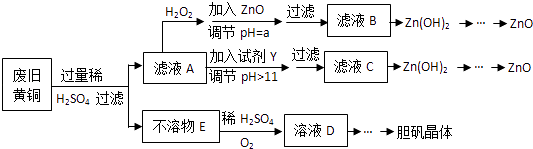
已知:Zn及化合物的性质与Al及化合物的性质相似,pH>11时Zn(OH)2能溶于NaOH溶液生成[Zn(OH)4]2﹣下表列出了几种离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol•L﹣1计算).
Fe3+
Fe2+
Zn2+
开始沉淀的pH
1.1
5.8
5.9
沉淀完全的pH
3.0
8.8
8.9
请回答下列问题:
(1)、加入ZnO调节pH=a的目的是 , a的范围是 .(2)、由不溶物E生成溶液D的化学方程式为 .(3)、滤液A中加入H2O2反应的离子方程式为 .(4)、由溶液D制胆矾晶体包含的主要操作步骤是 .(5)、下列试剂可作为Y试剂的是 .A.ZnO B.NaOH C.Na2CO3D.ZnSO4
若在滤液C中逐滴加入盐酸直到过量,则产生的现象是 .