2018年中考科学错题集训10:金属
试卷更新日期:2018-03-13 类型:一轮复习
一、单选题
-
1. 实验室有一瓶标签脱落的固体试剂,现分别取少量的该固体进行下列实验。根据实验现象判断,该固体最可能是( )
实验操作
实验现象
取该固体于试管中,加水、振荡
固体不溶解
取该固体于试管中,加盐酸、振荡
固体溶解,无气泡产生
一氧化碳通过炽热的该固体,称固体质量、检测尾气
固体质量减轻,尾气中只检测到CO与CO2
A、碱 B、盐 C、金属单质 D、金属氧化物2. 在试管中放入一根镁条(已除去氧化膜),往其中加入硝酸银溶液至浸没镁条,观察到如下现象:①镁条表面迅速覆盖一层疏松的固体物质,经检验发现生成的固体物质中单质银;
②镁条表面 有明显的气泡现象,经检验发现气泡中有氢气。
对于上述实验现象的分析错误的是( )
A、镁能从硝酸银溶液中置换出银 B、镁跟硝酸银溶液反应会生成氢气 C、镁投入硝酸银溶液中只发生2AgNO3+Mg=Mg(NO3)2+2Ag D、根据该实验可判断镁比银化学活动性强3.金属M与 溶液反应的化学方程式为:
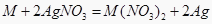 .则下列说法错误的是( )A、M的金属活动性比Ag强 B、金属M可能是铜 C、该反应属于复分解反应 D、该反应前后M的化合价发生了改变4. 在托盘天平的两边各放一只烧杯,调节天平至平衡,向两烧杯中分别注入等质量、等质量分数的稀硫酸(足量),然后向右盘的烧杯中放入一定质量的Fe粉,同时向左盘的烧杯中放入与Fe粉等质量的Zn粉,反应过程中可能出现的现象是( )A、天平最终仍然平衡 B、天平指针先偏向左盘,后偏向右盘 C、天平指针始终偏向右盘 D、天平指针先偏向右盘,后偏向左盘5. 将相同体积,相同溶质质量分数的稀硫酸,分别加入到等质量颗粒大小相同的X、Y、Z3种较活泼金属(金属完全反应),生成H2的质量与反应时间的关系如图;下列说正确的是( )
.则下列说法错误的是( )A、M的金属活动性比Ag强 B、金属M可能是铜 C、该反应属于复分解反应 D、该反应前后M的化合价发生了改变4. 在托盘天平的两边各放一只烧杯,调节天平至平衡,向两烧杯中分别注入等质量、等质量分数的稀硫酸(足量),然后向右盘的烧杯中放入一定质量的Fe粉,同时向左盘的烧杯中放入与Fe粉等质量的Zn粉,反应过程中可能出现的现象是( )A、天平最终仍然平衡 B、天平指针先偏向左盘,后偏向右盘 C、天平指针始终偏向右盘 D、天平指针先偏向右盘,后偏向左盘5. 将相同体积,相同溶质质量分数的稀硫酸,分别加入到等质量颗粒大小相同的X、Y、Z3种较活泼金属(金属完全反应),生成H2的质量与反应时间的关系如图;下列说正确的是( )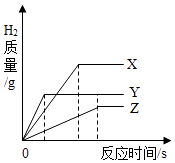 A、消耗稀盐酸的质量顺序为 Z>Y>X B、产生H2的速率顺序为X>Y>Z C、3种金属的活动性顺序为Y>X>Z D、相对原子质量有大到小顺序X>Y>Z6. 某金属加工厂生产过程中的废液含有少量硝酸银和硝酸铜,为回收利用资源和防止污染,该厂向废液中加入一定量的铁粉,反应停止后过滤,向滤出的固体中加入少量稀盐酸,无气体产生。则下列说法正确的是( )A、滤出的固体中一定有银和铜,一定不含铁 B、滤出的固体中一定有银,可能含有铜和铁 C、滤液中一定有硝酸亚铁,可能有硝酸银和硝酸铜 D、滤液中一定有硝酸亚铁,一定没有硝酸银和硝酸铜7. 镍氢充电电池有着广泛应用,镍及其化合物能发生下列反应:①Ni+2HCl=NiCl2+H2↑;②NiO+2HCl=NiCl2+H2O;③NiO2+4HCl=NiCl2+Cl2↑+2H2O;Ni(OH)2不溶于水。对上述反应的分析判断错误的是( )
A、消耗稀盐酸的质量顺序为 Z>Y>X B、产生H2的速率顺序为X>Y>Z C、3种金属的活动性顺序为Y>X>Z D、相对原子质量有大到小顺序X>Y>Z6. 某金属加工厂生产过程中的废液含有少量硝酸银和硝酸铜,为回收利用资源和防止污染,该厂向废液中加入一定量的铁粉,反应停止后过滤,向滤出的固体中加入少量稀盐酸,无气体产生。则下列说法正确的是( )A、滤出的固体中一定有银和铜,一定不含铁 B、滤出的固体中一定有银,可能含有铜和铁 C、滤液中一定有硝酸亚铁,可能有硝酸银和硝酸铜 D、滤液中一定有硝酸亚铁,一定没有硝酸银和硝酸铜7. 镍氢充电电池有着广泛应用,镍及其化合物能发生下列反应:①Ni+2HCl=NiCl2+H2↑;②NiO+2HCl=NiCl2+H2O;③NiO2+4HCl=NiCl2+Cl2↑+2H2O;Ni(OH)2不溶于水。对上述反应的分析判断错误的是( )
A、镍能与氯化铜溶液发生置换反应 B、反应②和③都是复分解反应 C、NiCl2能与NaOH溶液发生复分解反应 D、反应①、③中Ni的化合价都发生了变化8. 现有由FeO、Fe2O3、Fe3O4组成的混合物,经测知铁元素与氧元素的质量比为21:8,则此混合物中FeO、Fe2O3、Fe3O4的质量比不可能为( )A、9:20:3 B、9:20:5 C、40:18:7 D、27:60:89. 在托盘天平的两盘上各放一只质量相同的烧杯,在两只烧杯里分别加入等质量、等溶质质量分数的稀硫酸,将天平调节至平衡,然后向左盘的烧杯中加入5.6g铁,反应物之间恰好完全反应.欲使天平恢复平衡,则可向右盘的烧杯中加入( )A、5.6g锌 B、5.6g氧化钙 C、5.6g镁 D、5.6g硫酸镁10.往硝酸铜、硝酸银和硝酸亚铁的混合溶液中缓慢连续加入质量为m的锌粉,溶液中析出固体的质量与参加反应的锌粉质量关系如图所示,下列说法中正确的是( )
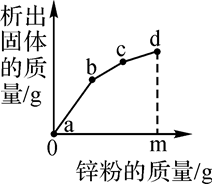 A、c点对应溶液中含有的金属离子为Zn2+和Cu2+ B、bc段(不含两端点)析出的金属是Fe C、ab段(不含两端点)对应溶液中含有的金属离子为Zn2+、Ag+、 Cu2+和Fe2+ D、若bc段和cd段中析出固体质量相等,参加反应的锌粉质量分别为m1和m2 , 则m1>m2
A、c点对应溶液中含有的金属离子为Zn2+和Cu2+ B、bc段(不含两端点)析出的金属是Fe C、ab段(不含两端点)对应溶液中含有的金属离子为Zn2+、Ag+、 Cu2+和Fe2+ D、若bc段和cd段中析出固体质量相等,参加反应的锌粉质量分别为m1和m2 , 则m1>m2二、填空题
-
11. 探究Fe、Cu、Ag三种金属的活动性顺序时,可选用的一组试剂是 ,有关反应的化学方程式为 .12. 我国第四套人民币中的一元硬币是钢芯镀镍(Ni),镍与稀硫酸能发生下列反应:Ni+H2SO4═NiSO4+H2↑。 根据此材料及金属活动性顺序,请回答:(1)、铸造硬币用到的材料是材料(填“有机合成”、“金属”或“无机非金属”);(2)、写出Ni与CuSO4溶液发生置换反应的方程式13. 在Cu(NO3)2、Zn(NO3)2、AgNO3的混合溶液中加入一定量的铁粉,充分反应后过滤,往滤渣中滴加稀硫酸时有气泡产生,则滤液中含有的溶质是;滤液质量比原混合溶液的质量(填“大”或“小”);有关反应的化学方程式为(写出一个即可).14.
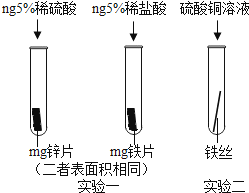
小明为探究锌、铁、铜三种金属的活动性顺序,设计了如图所示的两个实验:
①实验一中,小明以“金属表面产生气泡的快慢”为标准来判断锌、铁的活动性强弱,有同学认为不够合理,理由是 ;
②实验二中,若出现 现象,可证明铁的活动性强于铜,该反应的化学方程式为 .
三、实验探究题
-
15.
某同学为比较镁和铝的金属活动性强弱,将两块表面积相同并除去氧化膜的镁条、铝条分别与相同体积,相同质量分数的稀硫酸反应,测定两种金属与稀硫酸反应得到相同体积氢气所需要的时间。
 (1)、两种金属与稀硫酸反应得到相同体积氢气所需要的金属m镁m铝(填<、>或=)。(2)、利用图甲中A、B仪器可以组装一套实验室量取氢气体积的装置,该装置导管的连接顺序是(3)、图乙中量气管和水准管也可以用来测量氢气体积,为了准确地测量氢气体积,在读取量气管中液面读数的过程中,应注意 (填字母编号)。A、保持水准管静止,待水准管中液面不再上升时再读数 B、读数前应上下移动水准管,待两管液面相平再读数 C、读数时视线与凹液面最低处相平16. 已知某混合气体由H2、CO和CO2三种气体组成。为验证该混合气体成分,科学研究小组的同学经过讨论,设计了如图1所示的实验方案。
(1)、两种金属与稀硫酸反应得到相同体积氢气所需要的金属m镁m铝(填<、>或=)。(2)、利用图甲中A、B仪器可以组装一套实验室量取氢气体积的装置,该装置导管的连接顺序是(3)、图乙中量气管和水准管也可以用来测量氢气体积,为了准确地测量氢气体积,在读取量气管中液面读数的过程中,应注意 (填字母编号)。A、保持水准管静止,待水准管中液面不再上升时再读数 B、读数前应上下移动水准管,待两管液面相平再读数 C、读数时视线与凹液面最低处相平16. 已知某混合气体由H2、CO和CO2三种气体组成。为验证该混合气体成分,科学研究小组的同学经过讨论,设计了如图1所示的实验方案。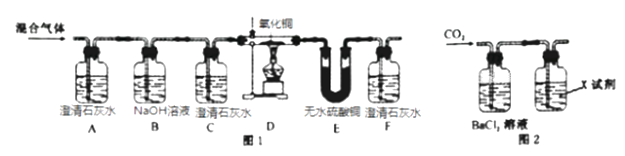 (查阅资料可知:CuO+H2
(查阅资料可知:CuO+H2 Cu+H2O;CuO+CO
Cu+H2O;CuO+CO Cu+CO2 )
Cu+CO2 )根据方案回答下列问题:
(1)、装置C在实验中的作用是。(2)、若证明混合气体中一定存在CO,那么依据的现象是 。(3)、小丁根据装置E中出现白色硫酸铜粉末变成蓝色的实验现象,得出该混合气体中有氢气存在的结论。你认为结论是否可靠?若可靠,请说明理由;若不可靠,请对图1实验装置提出改进意见。。(4)、图1方案中B装置可用来吸收CO2但没有现象。为证明CO2和NaOH能发生反应,小丁又设计了图2所示的方案。则图2方案中所加试剂X应该是。17. 整理实验器材时,小柯将还在反应的锌和稀硫酸的残留物,倒入有少量硫酸铜溶液的废液缸中,观察到锌粒表面产生气泡的速度大大加快。对此,他十分好奇:与硫酸铜溶液混合怎么会加快锌和稀硫酸的反应速度?查阅资料:①相互接触的两种活动性不同的金属,同时放入酸中,活动性较强的金属与酸反应产生氢气的速度会大大加快。 ②硫酸铜对锌和稀硫酸反应没有催化作用。
小柯根据下表进行实验,观察并记录现象。
组别
第一组
第二组
A
B
C
D
金属
锌片
绑有铜片的锌片
铁片
绑有铜片的铁片
30%硫酸溶液(mL)
20
?
20
20
产生气泡快慢
快
明显加快
慢
明显加快
(1)、第一组实验中“?”处的数据应为。(2)、为了定量比较产生气体的快慢,可以测量“收集相同体积的氢气所需的时间”或测量 , 然后进行比较。
(3)、请推测与废液缸中少量硫酸铜溶液混合后,锌料与稀硫酸反应速度加快的原因。18.小金利用如图装置进行甲、乙对比实验,探究温度对CO和 Fe2O3反应的影响(固定装置略)
 (1)、从实验安全角度考虑,图示装置还应采取的改进措施是。(2)、完全反应后,两组的生成物均为黑色粉末(纯净物),分别用两组生成物进行以下实验:
(1)、从实验安全角度考虑,图示装置还应采取的改进措施是。(2)、完全反应后,两组的生成物均为黑色粉末(纯净物),分别用两组生成物进行以下实验:步骤
操作
甲组现象
乙组现象
1
称量黑色粉末质量/g
m1
m2
2
取黑色粉末,用磁铁吸引
能被吸引
能被吸引
3
取黑色粉末,加入稀盐酸
全部溶解,有大量气泡
无明显现象
4
取黑色粉末,加入足量硫酸铜溶液
有红色物质生成
无明显现象
①甲组的黑色粉末与稀盐酸反应的化学方程式是。
②小金查阅资料后发现Fe3O4在常温下不与稀盐酸、CuSO4溶液反应,故猜想乙组的生成物为Fe3O4。他又发现m2恰好g,这可成为支持上述猜想的新证据。
(3)、甲、乙两组实验说明温度对CO和Fe2O3反应有影响,且均体现出CO的(填写化学性质)。
四、综合题
-
19. 我市某化工厂排放的废液中含有硫酸铜和硫酸亚铁.某化学兴趣小组的同学取了适量的上述废液样品,将一定量锌粉加入样品中,充分反应后过滤,得到滤液A和固体B.
请回答下列有关问题:
(1)、关于滤液A所含溶质的猜想中,不合理的是(填写序号).①猜想一:只有硫酸锌 ②猜想二:硫酸锌.硫酸亚铁
③猜想三:硫酸锌.硫酸亚铁.硫酸铜 ④猜想四:硫酸锌.硫酸铜
(2)、设计简单实验,确定“猜想二”对应的固体B的成分:.(3)、反应后析出金属的质量(选填“一定”或“不一定”)比参加反应的金属质量小.五、解答题
-
20. 在学习了金属的化学性质后,科学老师布置了一项课外学习任务:调查化工颜料店出售 的涂料添加剂“银粉”是什么金属?某学习小组通过调查,分别获得了“银粉”是银粉、铝粉、 锌粉这三种不同结果。为了确定究竟是哪一种金属,学习小组同学将一小包“银粉”带回实 验室,进行了如下实验和分析。(相关反应的化学方程式为:Zn+2HCl=ZnCl2+H2↑;2Al+6HCl=2AlCl3+3H2↑)
(1)、取少量“银粉”于试管中,滴加适量盐酸,观察到有产生,说明“银粉”一定不是银。(2)、为了进一步确定“银粉”是铝还是锌,学习小 组通过理论计算,获得两种金属分别与足量盐酸反应产生氢气的质量关系,并绘制成如图所示图像。
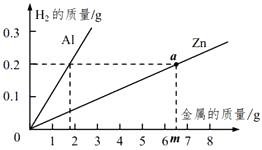
取1.8克“银粉”(杂质忽略不计)加入到50克稀盐酸中,恰好完全反应,生成氢气0.2克。根据上图可知,“银粉”是。计算实验中所用稀盐酸的溶质质量分数。
21.现有铜与金属镁、铁、锌中的一种组成的混合物,现欲测定其组成。
【实验步骤及数据】取该混合物粉末8.0 g放入烧杯中,将140.0 g 溶质质量分数为14.0%的稀硫酸平均分四次加入该烧杯中,充分反应后,测得剩余固体质量数据记录如图:


通过计算(写出计算过程),求:
(1)、该混合物粉末中铜的质量分数;(2)、实验室有一瓶浓硫酸,仔细观察标签:现要用这瓶浓硫酸稀释成质量分数为本实验所用的稀硫酸140g,需要取原硫酸溶液多少毫升;(3)、通过计算说明与铜混合的是哪种金属;(4)、第三次加入硫酸充分反应后,所得溶液中溶质的质量分数是多少?(本题数据保留一位小数)
-