备考2018年中考 化学一轮基础复习:专题十一 化学方程式的相关计算
试卷更新日期:2018-03-13 类型:一轮复习
一、单选题
-
1. 质量相等的a、b两份氯酸钾,其中a份为纯净氯酸钾,在b份中混入二氧化锰,分别同时加热,下列放出氧气质量(m)与反应时间(t)的关系图象中正确的是( )
A、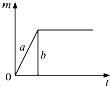 B、
B、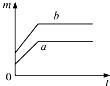 C、
C、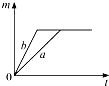 D、
D、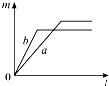 2. 镁铝合金xg和足量盐酸反应生成0.1gH2 , 则x可能为( )A、0.8 B、1 C、1.5 D、无法确定3. a、b、c三种酸分别与足量的金属Mg充分反应,生成等质量的H2 , 反应消耗a、b、c的分子数目之比为3:6:2.下列关于a、b、c的推理合理的是(HX、H2Y、H3Z分别表示三种酸)( )A、a、b、c可能分别为HX、H3Z、H2Y B、a、b、c可能分别为H3Z 、H2Y、HX C、a、b、c可能分别为HX、H2Y、H3Z D、a、b、c可能分别为H2Y、HX、H3Z4. 等质量的碳素钢、生铁放入两支试管中各加入过量的稀盐酸,充分反应后产生氢气的情况是( )
2. 镁铝合金xg和足量盐酸反应生成0.1gH2 , 则x可能为( )A、0.8 B、1 C、1.5 D、无法确定3. a、b、c三种酸分别与足量的金属Mg充分反应,生成等质量的H2 , 反应消耗a、b、c的分子数目之比为3:6:2.下列关于a、b、c的推理合理的是(HX、H2Y、H3Z分别表示三种酸)( )A、a、b、c可能分别为HX、H3Z、H2Y B、a、b、c可能分别为H3Z 、H2Y、HX C、a、b、c可能分别为HX、H2Y、H3Z D、a、b、c可能分别为H2Y、HX、H3Z4. 等质量的碳素钢、生铁放入两支试管中各加入过量的稀盐酸,充分反应后产生氢气的情况是( )
A、一样多 B、钢产生得多 C、生铁产生得多 D、无法比较5. 在化学反应A+B2═2C中,已知20g A和足量B2充分反应后,生成30g C.已知B的相对原子质量为16,则C的相对原子质量是( )A、20 B、32 C、48 D、966. 已知:Cu2O+H2SO4═Cu+CuSO4+H2O。16.0g CuO与CO反应得到Cu、Cu2O混合物13.6g,将此混合物溶于足量的100.0g稀H2SO4得9.6gCu.下列说法正确的是( )A、生成2.4g CO2 B、混合物中含9.6g铜元素 C、混合物中Cu与Cu2O的质量之比为8:9 D、反应后溶液中CuSO4的质量分数约为7.0%7. 在托盘天平的两盘上各放一只质量相同的烧杯,分别加入等质量、等溶质质量分数的足量稀盐酸,将天平调节至平衡.然后向左盘的烧杯中加入4.0含钙元素的质量分数为50%的碳酸钙与氧化钙的固体混合物,使之完全反应.欲使天平恢复平衡,可向右盘的烧杯中加入( )A、3.5g氢氧化钠溶液 B、2.8g氧化铁 C、2.8g碳酸钠溶液 D、2.4g镁8. 取一定质量的CaCO3高温加热一段时间后,冷却,测得剩余固体的质量为8.0g,剩余固体中钙元素质量分数为50.0%.下列判断正确的是( )A、生成2.0 gCO2气体 B、原来CaCO3的质量为14.3 g C、生成了5.6 gCaO D、剩余CaCO3的质量为3.0 g9. 如图所示的四个图象,能正确反映对应变化关系的是( )A、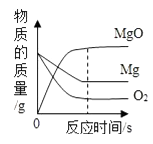 镁在氧气中燃烧
B、
镁在氧气中燃烧
B、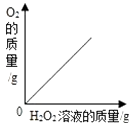 向二氧化锰中加入过氧化氢溶液
C、
向二氧化锰中加入过氧化氢溶液
C、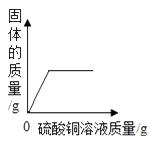 向一定量铁粉和铜粉的混合物中加入硫酸铜溶液
D、
向一定量铁粉和铜粉的混合物中加入硫酸铜溶液
D、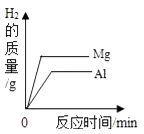 等质量的镁、铝分别与质量分数相等且足量的稀硫酸反应
10. 某同学为了测定铜镁合金样品中铜的质量分数,将100g稀盐酸分2次加入到盛有5g该样品的烧杯中,所得数据如表,则下列说法中错误的是( )
等质量的镁、铝分别与质量分数相等且足量的稀硫酸反应
10. 某同学为了测定铜镁合金样品中铜的质量分数,将100g稀盐酸分2次加入到盛有5g该样品的烧杯中,所得数据如表,则下列说法中错误的是( )次数
实验前
第1次
第2次
加入稀盐酸的质量/g
0
50
50
剩余固体的质量/g
5
3
2
A、第1次加入稀盐酸后剩余固体中还有镁 B、第2次所加入的稀盐酸未反应完 C、每50g稀盐酸和1g镁恰好完全反应 D、合金样品中铜的质量分数为40%二、填空题
-
11. 电解食盐水可得到烧碱、氯气(Cl2)和一种可燃性气体,反应的化学方程式为;配制质量分数为5%的氯化钠溶液,若量取水时俯视量筒刻度读数(其他操作正确),溶液的质量分数5%(填“大于”、“小于”或“等于”);现有NaCl和NaBr的混合物共2.2g,溶于水并加入过量的AgNO3溶液后,生成AgCl和AgBr沉淀共4.75g,则原混合物的含钠元素的质量为g.
三、实验探究题
-
12. 有一种管道疏通剂,主要成分为铝粉和氢氧化钠混合粉末.工作原理是:利用铝和氢氧化钠遇水反应放出大量的热,加快氢氧化钠对毛发等淤积物的腐蚀,同时产生氢气增加管道内的气压,利于疏通.小柯利用如图装置测定疏通剂中铝的质量分数.
Ⅰ.取样品20g,倒入容积为200mL的锥形瓶中,然后在分流漏斗中加入水,置于电子天平上测出总质量m1 .
Ⅱ.打开活塞,加入足量的水充分反应,直到没有固体剩余,静置一段时间,测出总质量m2 .
Ⅲ.实验数据如下表:
反应前总质量m1
反应后总质量m2
371.84g
371.24g

回答下列问题:
(1)、配平化学方程式:2Al+2NaOH+2H2O NaAlO2+3H2↑(2)、根据化学方程式计算样品中铝的质量分数.(3)、以下情形会导致样品中铝的质量分数测量结果偏高的原因可能有 .A、向锥形瓶中倒入样品时,撒出了部分粉末 B、在反应过程中有水蒸气逸出 C、没有等装置中氢气全部排尽就称量.四、计算题
-
13. 实验室有一份部分被氧化成氧化镁的镁粉样品,未知浓度盐酸和40%的氢氧化钠溶液,兴趣小组同学为分析样品中金属镁的质量分数含量和计算盐酸的质量分数,进行如下探究:
(1)、用盐酸溶解样品(样品混合均匀),测定生成氢气质量,实验数据如表所示:实验序号
所取样品质量(g)
所加盐酸质量(g)
生成氢气质量(g)
Ⅰ
16.0
60.0
0.5
Ⅱ
16.0
130.0
1.0
Ⅲ
16.0
150.0
1.0
镁粉样品中金属镁的质量百分含量为 .
(2)、向实验Ⅲ后的溶液中加入40%的氢氧化钠溶液,生成沉淀的质量随加入氢氧化钠溶液质量的变化关系如图所示.计算盐酸的质量分数.(写出计算过程)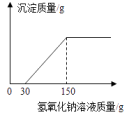
-
-