备考2018年高考化学二轮专题复习 专题十三:化学实验基础
试卷更新日期:2018-03-12 类型:二轮复习
一、单选题
-
1. 下列除去杂质的方法正确的有( )个
①除去乙烷中少量的乙烯:光照条件下通入Cl2 , 气液分离;
②除去乙烯的SO2:气体通过盛酸性高锰酸钾溶液的洗气瓶;
③除去CO2中少量的SO2:气体通过盛酸性高锰酸钾溶液的洗气瓶;
④除去乙醇中少量的水:加足量生石灰,蒸馏.
⑤溴苯中混有溴:加入KI溶液,振荡,用汽油萃取出溴
⑥乙醇(甲酸):加入足量饱和碳酸钠溶液充分振荡,蒸馏,收集馏出物
⑦溴乙烷(乙醇):多次加水振荡,分液,弃水层
⑧苯(苯酚):加溴水,振荡,过滤除去沉淀.
A、3 B、4 C、5 D、62. 下列操作或装置能达到实验目的的是( )A、 B、
B、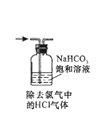 C、
C、 D、
D、 3. 图所示的实验装置图正确且能达到相应实验目的是( )A、
3. 图所示的实验装置图正确且能达到相应实验目的是( )A、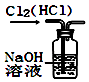 用图所示装置除去Cl2中的HCl
B、
用图所示装置除去Cl2中的HCl
B、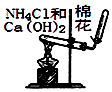 用图所示装置实验室制NH3
C、
用图所示装置实验室制NH3
C、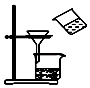 用图所示装置分离MnO2和KCl
D、
用图所示装置分离MnO2和KCl
D、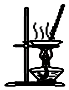 用图所示装置蒸干NH4Cl饱和溶液制备NH4Cl晶体
4. 下列有关实验误差分析中,不正确的是( )A、用湿润的pH试纸测稀碱液的pH值,测定值偏小 B、用容量瓶配制溶液,定容时俯视刻度线,所配溶液浓度偏小 C、滴定前滴定管内无气泡,终点读数时有气泡,所测体积偏小 D、测定中和反应的反应热时,将碱缓慢倒入酸中,所测温度值偏低5. 下列有关实验操作或实验原理叙述正确的是( )
用图所示装置蒸干NH4Cl饱和溶液制备NH4Cl晶体
4. 下列有关实验误差分析中,不正确的是( )A、用湿润的pH试纸测稀碱液的pH值,测定值偏小 B、用容量瓶配制溶液,定容时俯视刻度线,所配溶液浓度偏小 C、滴定前滴定管内无气泡,终点读数时有气泡,所测体积偏小 D、测定中和反应的反应热时,将碱缓慢倒入酸中,所测温度值偏低5. 下列有关实验操作或实验原理叙述正确的是( )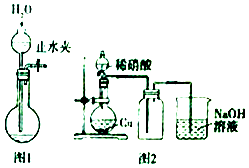 A、可以用pH试纸测定饱和氯水的pH B、用50mL量筒能够量取8.5mL0.1 mol•L﹣1盐酸 C、用图1所示操作检查装置的气密性 D、实验室用图2所示装置制取纯净的NO26. 下列实验操作中,完全正确的一组是( )
A、可以用pH试纸测定饱和氯水的pH B、用50mL量筒能够量取8.5mL0.1 mol•L﹣1盐酸 C、用图1所示操作检查装置的气密性 D、实验室用图2所示装置制取纯净的NO26. 下列实验操作中,完全正确的一组是( )①用试管夹夹持试管时,试管夹从试管的底部向上套,夹在试管的中上部 ②给盛有液体超过试管容积的试管加热 ③把鼻孔靠近容器口去闻气体的气味 ④将试管平放,用纸槽向试管里送入固体粉末,然后使试管竖立起来 ⑤取用放在细口瓶里的液体时,取下瓶塞倒放在桌面上,倾倒液体时,标签向着地面 ⑥将烧瓶放在桌面上,再将塞子用力塞上 ⑦用坩埚钳夹持加热后的蒸发皿 ⑧将滴管垂直伸进试管内滴加液体 ⑨稀释浓硫酸时,把水迅速倒进盛有浓硫酸的量筒中 ⑩检验装置的气密性时,把导管的一端浸入水中,用手掌握住容器或用酒精灯微热
A、①④⑦⑩ B、①④⑤⑦⑩ C、①④⑤⑦⑧⑨ D、④⑤⑦⑧⑨7. 下列实验操作或事故处理正确的是( )A、金属Na着火,立即用水扑灭 B、实验结束后,用嘴吹灭酒精灯 C、皮肤上不慎沾上浓NaOH溶液,立即用盐酸冲洗 D、稀释浓硫酸时,将浓硫酸沿器壁慢慢注入水中,并不断搅拌8.“封管实验”具有简易、方便、节约、绿色等优点,观察下面四个“封管实验”(夹持装置未画出),判断下列说法正确的是( )
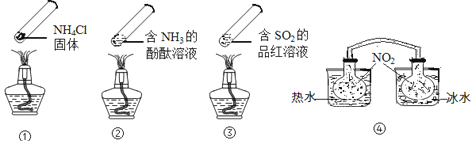 A、加热时,①上部汇集了固体NH4Cl,说明NH4Cl的热稳定性比较好 B、加热时,②、③溶液均变红,冷却后又都变为无色 C、④中,浸泡在热水中的容器内气体颜色变深,浸泡在冰水中的容器内气体颜色变浅 D、四个“封管实验”中所发生的化学反应都是可逆反应9. 仅用下表提供的玻璃仪器(非玻璃仪器任选)就能实现相应实验目的是( )
A、加热时,①上部汇集了固体NH4Cl,说明NH4Cl的热稳定性比较好 B、加热时,②、③溶液均变红,冷却后又都变为无色 C、④中,浸泡在热水中的容器内气体颜色变深,浸泡在冰水中的容器内气体颜色变浅 D、四个“封管实验”中所发生的化学反应都是可逆反应9. 仅用下表提供的玻璃仪器(非玻璃仪器任选)就能实现相应实验目的是( )选项
实验目的
玻璃仪器
A
分离乙醇和乙酸的混合物
分液漏斗、烧杯、玻璃棒
B
用0.10mol/L的盐酸配制
100mL 0.050mol/的盐酸
100mL容量瓶、烧杯、玻璃棒、胶头滴管
C
用溴水、淀粉KI溶液比较
Br2和I2的氧化性强弱
试管、胶头滴管
D
用NH4Cl固体和Ca(OH)2固体制备并收集NH3
酒精灯、烧杯、导管、集气瓶
A、A B、B C、C D、D10. 下列实验正确的是( )A、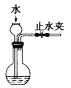 检查装置气密性
B、
检查装置气密性
B、 蒸发、浓缩、结晶
C、
蒸发、浓缩、结晶
C、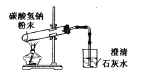 碳酸氢钠受热分解
D、
碳酸氢钠受热分解
D、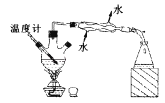 分离沸点不同且互溶的液体混合物
11.
分离沸点不同且互溶的液体混合物
11.下列有关实验的说法不正确的是( )
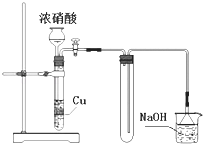 A、用广泛pH试纸测得0.051 mol•L﹣1 H2SO4溶液的pH=1 B、某气体制备装置如右图,该装置可减少污染性气体的泄漏,且有利于收集到空气含量较低的气体 C、在分液操作中,当试液分层后,打开旋塞,将下层液体放出,然后关闭旋塞,将上层液体从上口倒出 D、10mL溴水与5mL正己烷混合,在光照下振荡后静置,当试液分为上、下两层且几乎无色时,用玻璃棒蘸取浓氨水伸入液面上方,可观察到有白烟生成12. 仅用下表提供的仪器(夹持仪器和试剂任选)不能实现相应实验目的是( )
A、用广泛pH试纸测得0.051 mol•L﹣1 H2SO4溶液的pH=1 B、某气体制备装置如右图,该装置可减少污染性气体的泄漏,且有利于收集到空气含量较低的气体 C、在分液操作中,当试液分层后,打开旋塞,将下层液体放出,然后关闭旋塞,将上层液体从上口倒出 D、10mL溴水与5mL正己烷混合,在光照下振荡后静置,当试液分为上、下两层且几乎无色时,用玻璃棒蘸取浓氨水伸入液面上方,可观察到有白烟生成12. 仅用下表提供的仪器(夹持仪器和试剂任选)不能实现相应实验目的是( )选项
实验目的
仪器
A
除去氢氧化铝胶体中的泥沙
漏斗(带滤纸)、烧杯、玻璃棒
B
从食盐水中获得NaCl晶体
坩埚、玻璃棒、酒精灯、泥三角
C
用0.1000mol•L﹣1的盐酸测定未
知浓度的NaOH溶液浓度
碱式滴定管、酸式滴定管、锥形瓶、胶头滴管、烧杯
D
用MnO2和浓盐酸制取干燥、纯
净的Cl2
圆底烧瓶、分液漏斗、酒精灯、洗气瓶、集气瓶、导管、石棉网
A、A B、B C、C D、D13. 列操作或装置能达到实验目的是( )A
B
C
D

分离互溶但沸点相差较大的液体混合物
钠在空气中燃烧
检验铁粉与水蒸气反应产生的氢气
探究碳酸钠和碳酸氢钠的稳定性
A、A B、B C、C D、D14. 下列有关实验操作、现象和结论均正确的是( )选项
实验操作
现象
结论
A
某溶液中滴加足量盐酸酸化的 BaCl2溶液
生成白色沉淀
原溶液中一定含有SO42﹣
B
将Cl2通入石蕊试液中
石蕊试液先变红 后褪色
Cl2具有漂白性
C
用洁净的铂丝蘸取某溶液进行焰色反应实验
火焰呈黄色
原溶液一定含有Na+ , 一定不含K+
有
D
将KI和FeCl3溶液在试管中混 合后,加入CCl4 , 振荡,静置
下层溶液显紫红 色
氧化性Fe3+>I2
A、A B、B C、C D、D15. 下列有关实验操作的说法正确的是( )A、用10mL量筒量取8.10mL稀盐酸 B、可用25mL酸式滴定管量取20.00mL KMnO4溶液 C、用pH试纸测定溶液的pH时,需先用蒸馏水润湿试纸 D、用pH计测得某溶液的pH为216. 下列物质的检验,其结论一定正确的是( )A、向某溶液中加入BaCl2溶液,产生白色沉淀,加入HNO3后,白色沉淀不溶解,也无其他现象,说明原溶液中一定含有SO42﹣ B、向某溶液中加盐酸产生无色气体,该气体能使澄清的石灰水变浑浊,说明该溶液中一定含有CO32﹣或SO32﹣ C、取少量久置的Na2SO3样品于试管中加水溶解,再加盐酸酸化,然后加BaCl2溶液,若加盐酸有气体产生,加BaCl2有白色沉淀产生,说明Na2SO3样品已部分被氧化 D、将某气体通入品红溶液中,品红溶液褪色,该气体一定是SO217. 从海带中制取单质碘需要经过灼烧、溶解、过滤、氧化、萃取、分液、蒸馏等操作.下列图示对应的装置合理、操作规范的是( )A、 灼烧
B、
灼烧
B、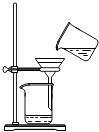 过滤
C、
过滤
C、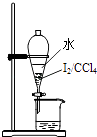 分液
D、
分液
D、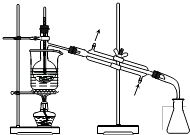 蒸馏
蒸馏
二、填空题
-
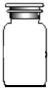
18.
如图中A、B、C、D是常见的普通玻璃试剂瓶.请把下列试剂的序号填写在适合盛放的试剂瓶下面的括号内:
a.浓硫酸 b.碳酸钠溶液 c.铝片 d.浓硝酸 e.氢氧化钠溶液 f.二氧化锰
A
B
C
D

三、综合题
-
19.
硼氢化钠(NaBH4)在化工等领域具有重要的应用价值,某研究小组采用偏硼酸钠NaBO2为主要原料制备NaBH4 , 其流程如下:
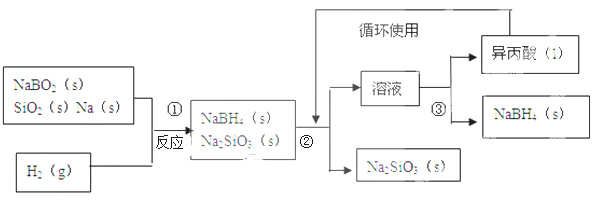
已知:NaBH4常温下能与水反应,可溶于异丙酸(沸点:33℃)。
(1)、在第①步反应加料之前,需要将反应器加热至100℃以上并通入氩气,该操作的目的是 ,原料中的金属钠通常保存在 中,实验室取用少量金属钠需要用到的实验用品有 , ,玻璃片和小刀等;
(2)、请配平第①步反应的化学方程式: NaBO2+ SiO2+ Na+ H2=NaBH4+2Na2SiO3;
(3)、第②步分离采用的方法是 ;第③步分离(NaBH4)并回收溶剂,采用的方法是 .
(4)、NaBH4(s)与H2O(l)反应生成NaBO2(s)和H2(g),在25℃,101KPa下,已知每消耗3.8克NaBH4(s)放热21.6KJ,该反应的热化学方程式是 。
四、实验探究题
-
20.
苯甲酸甲酯是一种重要的工业原料,有机化学中通过酯化反应原理,可以进行苯甲酸甲酯的合成.有关物质的物理性质、实验装置如下所示:
苯甲酸
甲醇
苯甲酸甲酯
熔点/℃
122.4
﹣97
﹣12.3
沸点/℃
249
64.3
199.6
密度/g.cm﹣3
1.2659
0.792
1.0888
水溶性
微溶
互溶
不溶
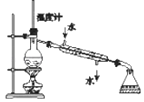
实验一:制取苯甲酸甲酯
在大试管中加入15g苯甲酸和一定量的甲醇,边振荡边缓慢加入一定量浓硫酸,按图A连接仪器并实验.
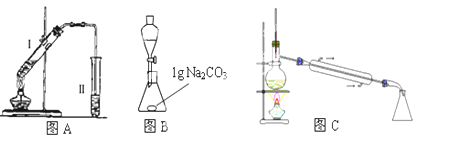 (1)、苯甲酸与甲醇反应的化学方程式为(2)、中学实验室中制取乙酸乙酯时为了提高酯的产率可以采取的措施有(3)、实验二:提纯苯甲酸甲酯
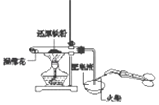
(1)、苯甲酸与甲醇反应的化学方程式为(2)、中学实验室中制取乙酸乙酯时为了提高酯的产率可以采取的措施有(3)、实验二:提纯苯甲酸甲酯该实验要先利用图B装置把图A中制备的苯甲酸甲酯水洗提纯,再利用图C装置进行蒸馏提纯
(3)用图B装置进行水洗提纯时,B装置中固体Na2CO3作用是
(4)、用图C装置进行蒸馏提纯时,当温度计显示 时,可用锥形瓶收集苯甲酸甲酯.
-
-