备考2018年高考化学二轮专题复习 专题十一:水溶液中的离子平衡
试卷更新日期:2018-03-12 类型:二轮复习
一、单选题
-
1. 常温下,浓度均为1.0mol•L﹣1的NH3•H2O和NH4Cl混合溶液10mL,测得其pH为9.3.下列有关叙述正确的是( )A、加入适量的NaCl,可使c(NH4+)=c(Cl﹣) B、滴加几滴浓氨水,c(NH4+)减小 C、滴加几滴浓盐酸, 的值减小 D、1.0 mol•L﹣1的NH4Cl溶液中c(NH4+)比该混合溶液大2. 有0.1mol•L﹣1的三种溶液:①CH3COOH、②NaOH、③CH3COONa,下列说法正确的是( )A、溶液①中,c(CH3COO﹣)=c(H+) B、溶液①、②等体积混合,混合液中c(CH3COO﹣)等于溶液③中的c(CH3COO﹣) C、溶液①、②等体积混合,混合液中c(CH3COO﹣)+c(CH3COOH)=c(Na+) D、溶液①、③等体积混合,混合液中c(Na+)>c(CH3COO﹣)>c(H+)>c(OH﹣)3. 部分弱酸的电离平衡常数如下表:
弱酸
HCOOH
HCN
H2CO3
电离平衡常数(25℃)
Ka=1.77×10-4
Ka=4.9×10-10
Ka1=4.3×10-7
Ka2=5.6×10-11
在25℃时,下列选项不正确的是
A、反应CN-+H2O+CO2=HCN+HCO3-能够发生 B、中和等体积、等pH的HCOOH和HCN消耗NaOH的量,前者小于后者 C、物质的量浓度相等的HCOONa和KCN溶液中,c(Na+)-c(HCOO-)<c(K+)-c(CN-) D、c(NH4+) 相等的HCOONH4溶液、NH4CN溶液、NH4HCO3溶液中,c(NH4HCO3)>c(NH4CN)>c(HCOONH4)4. 下列事实一定能说明HA为弱电解质的有几句:( )①常温时NaA溶液的pH大于7;
②用HA溶液做导电实验,灯泡很暗;
③HA与NaCl不能反应;
④常温下0.1mol•L﹣1的HA溶液pH=2;
⑤1L pH=1的HA溶液加水稀释至100mL后溶液的pH=2.2;
⑥1L pH=1的HA溶液和1L pH=1的盐酸分别与足量的NaOH溶液完全反应,最终HA消耗的NaOH多;
⑦HA溶液中加水稀释,溶液中c(OH﹣)增大.
A、4句 B、5句 C、6句 D、7句5. 常温下,0.2 mol/L CH3COOH溶液与0.1 mol/L NaOH溶液等体积混合后(忽略混合前后溶液体积的变化),溶液的pH<7,则下列有关此溶液的叙述正确的是( )A、溶液中由水电离产生的H+浓度为1×10-7 mol/L B、c(CH3COO-)+c(CH3COOH)-c(Na+)=0.05 mol/L C、溶液中CH3COOH的电离程度小于CH3COONa的水解程度 D、溶液中离子浓度的大小关系为:c(Na+)>c(CH3COO-)>c(H+)>c(OH-)6. 下列关于电解质溶液的叙述正确的是( )A、常温下,在NH4Cl溶液中离子浓度大小顺序为c(Cl﹣)>c(NH4+)>c(H+)>c(OH﹣) B、将pH=4的醋酸溶液稀释后,溶液中所有离子的浓度均降低 C、中和pH与体积均相同的盐酸和醋酸溶液,消耗NaOH的物质的量相同 D、常温下,同浓度的Na2S与NaHS溶液相比,Na2S溶液的pH小7. 某温度下,相同pH值的盐酸和醋酸溶液分别加水稀释,平衡pH值随溶液体积变化的曲线如图所示.据图判断正确的是( ) A、Ⅱ为盐酸稀释时的pH值变化曲线 B、b点溶液的导电性比c点溶液的导电性强 C、a点Kw的数值比c点Kw的数值大 D、b点酸的总浓度大于a点酸的总浓度8. 在t℃时,AgBr在水中的沉淀溶解平衡曲线如图所示.又知t℃时AgCl的Ksp=4×10﹣10 , 下列说法不正确的是( )
A、Ⅱ为盐酸稀释时的pH值变化曲线 B、b点溶液的导电性比c点溶液的导电性强 C、a点Kw的数值比c点Kw的数值大 D、b点酸的总浓度大于a点酸的总浓度8. 在t℃时,AgBr在水中的沉淀溶解平衡曲线如图所示.又知t℃时AgCl的Ksp=4×10﹣10 , 下列说法不正确的是( )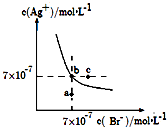 A、如图中a点对应的是AgBr的不饱和溶液 B、在t℃时,Ksp(AgBr)=4.9×10﹣13 C、在t℃时,AgCl(s)+Br﹣(aq)⇌AgBr(s)+Cl﹣(aq)的平衡常数K≈816 D、在AgBr的饱和溶液中加入NaBr固体,可使溶液由b点到以c点9.
A、如图中a点对应的是AgBr的不饱和溶液 B、在t℃时,Ksp(AgBr)=4.9×10﹣13 C、在t℃时,AgCl(s)+Br﹣(aq)⇌AgBr(s)+Cl﹣(aq)的平衡常数K≈816 D、在AgBr的饱和溶液中加入NaBr固体,可使溶液由b点到以c点9.水的电离平衡曲线如图所示,下列说法正确的是( )
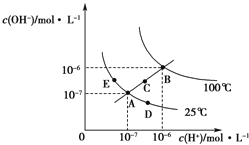 A、图中五点KW间的关系:B=C=A=D=E B、若从A点到D点,可采用:温度不变在水中加入少量的酸 C、若从A点到C点,可采用:温度不变在水中加入适量的NH4Cl固体 D、若处在B点时,将pH=2的硫酸与pH=10的KOH溶液等体积混合,溶液显酸性10. 下列说法不正确的是( )A、常温下,在0.1mol•L﹣1的HNO3溶液中,由水电离出的c(H+)< B、浓度为0.1mol•L﹣1的NaHCO3溶液:c(H2CO3)>c(CO32﹣) C、25℃时,AgCl固体在等物质的量浓度的NaCl、CaCl2溶液中的溶度积相同 D、冰醋酸中逐滴加水,溶液的导电性、醋酸的电离程度、pH均先增大后减小11. 一定温度下,水溶液中H+和OH﹣的浓度变化曲线如图,下列说法正确的是( )
A、图中五点KW间的关系:B=C=A=D=E B、若从A点到D点,可采用:温度不变在水中加入少量的酸 C、若从A点到C点,可采用:温度不变在水中加入适量的NH4Cl固体 D、若处在B点时,将pH=2的硫酸与pH=10的KOH溶液等体积混合,溶液显酸性10. 下列说法不正确的是( )A、常温下,在0.1mol•L﹣1的HNO3溶液中,由水电离出的c(H+)< B、浓度为0.1mol•L﹣1的NaHCO3溶液:c(H2CO3)>c(CO32﹣) C、25℃时,AgCl固体在等物质的量浓度的NaCl、CaCl2溶液中的溶度积相同 D、冰醋酸中逐滴加水,溶液的导电性、醋酸的电离程度、pH均先增大后减小11. 一定温度下,水溶液中H+和OH﹣的浓度变化曲线如图,下列说法正确的是( )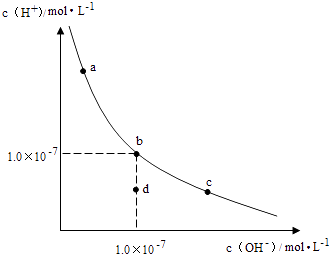 A、升高温度,可能引起由c向b的变化 B、该温度下,水的离子积常数为1.0×10﹣13 C、该温度下,加入FeCl3可能引起由b向a的变化 D、该温度下,稀释溶液可能引起由c向d的变化12. 25℃时,用0.1mol•L﹣1的CH3COOH溶液滴定20mL0.1mol•L﹣1的NaOH溶液,当滴加VmLCH3COOH溶液时,混合溶液的pH=7.已知CH3COOH的电离平衡常数为Ka , 忽略混合时溶液体积的变化,下列关系式正确的是( )A、Ka= B、V= C、K a= D、K a=13. 已知:Ksp(CuS)=6.0×10﹣36 , Ksp(ZnS)=3.0×10﹣25 , Ksp(PbS)=9.0×10﹣29 . 在自然界中,闪锌矿(ZnS)和方铅矿(PbS)遇硫酸铜溶液能转化成铜蓝(CuS).下列有关说法不正确的是( )A、硫化锌转化成铜蓝的离子方程式为ZnS(s)+Cu2+(aq)=Zn2+(aq)+CuS(s) B、在白色硫化锌浊液中滴加硝酸铅溶液,不会生成黑色沉淀(PbS) C、在水中的溶解度:S(ZnS)>S(PbS)>S(CuS) D、若溶液中c(Cu2+)=1×10﹣10mol•L﹣1 , 则S2﹣已完全转化成CuS14. 浓度均为0.10mol/L、体积均为V0的MOH和ROH溶液,分别加水稀释至体积V,pH随lg 的变化如图所示,下列叙述错误的是( )
A、升高温度,可能引起由c向b的变化 B、该温度下,水的离子积常数为1.0×10﹣13 C、该温度下,加入FeCl3可能引起由b向a的变化 D、该温度下,稀释溶液可能引起由c向d的变化12. 25℃时,用0.1mol•L﹣1的CH3COOH溶液滴定20mL0.1mol•L﹣1的NaOH溶液,当滴加VmLCH3COOH溶液时,混合溶液的pH=7.已知CH3COOH的电离平衡常数为Ka , 忽略混合时溶液体积的变化,下列关系式正确的是( )A、Ka= B、V= C、K a= D、K a=13. 已知:Ksp(CuS)=6.0×10﹣36 , Ksp(ZnS)=3.0×10﹣25 , Ksp(PbS)=9.0×10﹣29 . 在自然界中,闪锌矿(ZnS)和方铅矿(PbS)遇硫酸铜溶液能转化成铜蓝(CuS).下列有关说法不正确的是( )A、硫化锌转化成铜蓝的离子方程式为ZnS(s)+Cu2+(aq)=Zn2+(aq)+CuS(s) B、在白色硫化锌浊液中滴加硝酸铅溶液,不会生成黑色沉淀(PbS) C、在水中的溶解度:S(ZnS)>S(PbS)>S(CuS) D、若溶液中c(Cu2+)=1×10﹣10mol•L﹣1 , 则S2﹣已完全转化成CuS14. 浓度均为0.10mol/L、体积均为V0的MOH和ROH溶液,分别加水稀释至体积V,pH随lg 的变化如图所示,下列叙述错误的是( )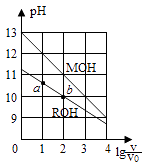 A、MOH的碱性强于ROH的碱性 B、ROH的电离程度:b点大于a点 C、若两溶液无限稀释,则它们的c(OH﹣)相等 D、当lg =2时,若两溶液同时升高温度,则 增大15.
A、MOH的碱性强于ROH的碱性 B、ROH的电离程度:b点大于a点 C、若两溶液无限稀释,则它们的c(OH﹣)相等 D、当lg =2时,若两溶液同时升高温度,则 增大15.电导率是衡量电解质溶液导电能力大小的物理量,根据溶液电导率变化可以确定滴定反应的终点。右图是用KOH溶液分别滴定HCl溶液和CH3COOH溶液的滴定曲线示意图。下列示意图中,能正确表示用NH3·H2O溶液滴定HCl和CH3COOH混合溶液的滴定曲线的是( )
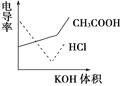
 A、A B、B C、C D、D
A、A B、B C、C D、D二、多选题
-
16. 已知常温下0.1mol/L的NH4HCO3溶液pH=7.8,已知含氮(或含碳)各微粒的分布分数(平衡时某种微粒的浓度占各种微粒浓度之和的分数)与pH的关系如图所示.下列说法不正确的是( )
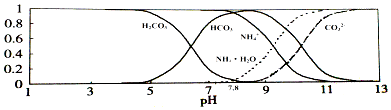 A、溶液的pH=9时,溶液中存在下列关系:c(HCO3﹣)>c(NH4+)>c(NH3•H2O)>c(CO32﹣) B、NH4HCO3溶液中存在下列守恒关系:c(NH4+)+c(NH3•H2O)=c(HCO3﹣)+c(CO32﹣)+c(H2CO3) C、由图可知,往该溶液中逐滴滴加氢氧化钠时NH4+和HCO3﹣浓度逐渐减小 D、通过分析可知常温下Ka1(H2CO3)>Kb(NH3•H2O)>Ka2(H2CO3)
A、溶液的pH=9时,溶液中存在下列关系:c(HCO3﹣)>c(NH4+)>c(NH3•H2O)>c(CO32﹣) B、NH4HCO3溶液中存在下列守恒关系:c(NH4+)+c(NH3•H2O)=c(HCO3﹣)+c(CO32﹣)+c(H2CO3) C、由图可知,往该溶液中逐滴滴加氢氧化钠时NH4+和HCO3﹣浓度逐渐减小 D、通过分析可知常温下Ka1(H2CO3)>Kb(NH3•H2O)>Ka2(H2CO3)三、填空题
-
17. (1)一定温度下,向1L 0.1mol•L﹣1 CH3COOH溶液中加入0.1mol CH3COONa固体,则醋酸的电离平衡向 (填“正”或“逆”)反应方向移动;溶液中的值 (填“增大”、“减小”或“不变”).
(2)氨气的水溶液称为氨水,其中存在的主要溶质微粒是NH3•H2O.已知:
a.常温下,醋酸和NH3•H2O的电离平衡常数均为1.74×10﹣5;
b.CH3COOH+NaHCO3═CH3COONa+CO2↑+H2O.
则CH3COONH4溶液呈 性(填“酸”、“碱”或“中”,下同),NH4HCO3溶液呈 性,NH4HCO3溶液中物质的量浓度最大的离子是 (填化学式).
(3)99℃时,Kw=1.0×10﹣12 , 该温度下测得0.1mol•L﹣1 Na2A溶液的pH=6.
①H2A在水溶液中的电离方程式为 .
②该温度下,将0.01mol•L﹣1 H2A溶液稀释到20倍后,溶液的pH= .
③体积相等、pH=1的盐酸与H2A溶液分别与足量的Zn反应,产生的氢气 .
A.盐酸多 B.H2A多
C.一样多 D.无法确定
④将0.1mol•L﹣1 H2A溶液与0.2mol•L﹣1氨水等体积混合,完全反应后溶液中各离子浓度从大到小的顺序为 .
四、实验探究题
-
18. 弱电解质的电离平衡、盐类的水解平衡和难溶物的溶液平衡均属于化学平衡.
I、已知H2A在水中存在以下平衡:H2A⇌H++HA﹣ , HA﹣⇌H++A2﹣ .
(1)、NaHA溶液的pH(填大于、小于或等于) Na2A溶液的pH.(2)、某温度下,若向0.1mol/L的NaHA溶液中逐滴滴加0.1mol/L KOH溶液至溶液呈中性.此时该混合溶液中下列关系中,一定正确的是 .a.c(H+)•c(OH﹣)=1×10﹣14 b.c(Na+)+c(K+)=c(HA﹣)+2c(A2﹣)
c.c(Na+)>c(K+) d.c(Na+)+c(K+)=0.05mol/L
(3)、已知常温下H2A的钙盐(CaA)饱和溶液中存在以下平衡:CaA(s)⇌Ca2+(aq)+A2﹣(aq)△H>0.①降低温度时,Ksp(填“增大”、“减小”或“不变”).
②滴加少量浓盐酸,c(Ca2+)(填“增大”、“减小”或“不变”).
(4)、II、含有Cr2O72﹣的废水毒性较大,某工厂废水中含5.00×10﹣3 mol•L﹣1的Cr2O72﹣ . 为使废水能达标排放,作如下处理:Cr2O72﹣ Cr3+、Fe3+ Cr(OH)3、Fe(OH)3
①该废水中加入绿矾(FeSO4•7H2O)和H+ , 发生反应的离子方程式为: .
②欲使10L该废水中的Cr2O72﹣完全转化为Cr3+ , 理论上需要加入g FeSO4•7H2O.
③若处理后的废水中残留的c(Fe3+)=2×10﹣13mol•L﹣1 , 则残留的Cr3+的浓度为 . (已知:Ksp[Fe(OH)3]=4.0×10﹣38 Ksp[Cr(OH)3]=6.0×10﹣31)
19. 某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:①将碱式滴定管用蒸馏水洗净,待测溶液润洗后,再注入待测溶液,调节滴定管的尖嘴部分充满溶液,并使液面处于“0“刻度以下的位置,记下读数;将锥形瓶用蒸馏水洗净后,用待测溶液润洗锥形瓶2~3次;从碱式滴定管中放入20.00mL待测溶液到锥形瓶中.②将酸式滴定管用蒸馏水洗净,再用标准酸液润洗2﹣3次后,向其中注入0.1000mol•L﹣1标准盐酸,调节滴定管的尖嘴部分充满溶液,并使液面处于“0“刻度以下的位置,记下读数.
③向锥形瓶中滴入酚酞作指示剂,进行滴定.滴定至指示剂刚好变色,且半分钟内颜色不再改变为止,测得所耗盐酸的体积为V1mL.
④重复以上过程,但在滴定过程中向锥形瓶加入5mL的蒸馏水,测得所耗盐酸的体积为V2mL.
滴定次数
待测液体积(mL)
标准盐酸体积/mL
滴定前读数(mL)
滴定后读数(mL)
第一次
25.00
0.50
20.40
第二次
25.00
4.00
24.00
试回答下列问题:
(1)、步骤③中锥形瓶中的溶液的颜色变化是由色时,停止滴定.(2)、滴定时边滴边摇动锥形瓶,眼睛应观察 .(3)、该小组在步骤①中的错误是 , 由此造成的测定结果(填“偏高”、“偏低”或“无影响”).(4)、步骤②缺少的操作是 .(5)、如图,是某次滴定时的滴定管中的液面,其读数为 mL.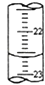
请计算待测烧碱溶液的浓度: mol/L.
五、综合题
-
20. 已知:
①25℃时弱电解质电离平衡数;Ka(CH3COOH)═1.8×10﹣5 , Ka(HSCN)═0.13;
难溶电解质的溶度积常数:KSD(CaF2)═1.5×10﹣10
②25℃时,2×10﹣3mol•L﹣1氢氟酸水溶液中,调节溶液pH(忽略体积变化),得到c (HF)、C(F﹣)与溶液pH的变化关系,如图1所示:
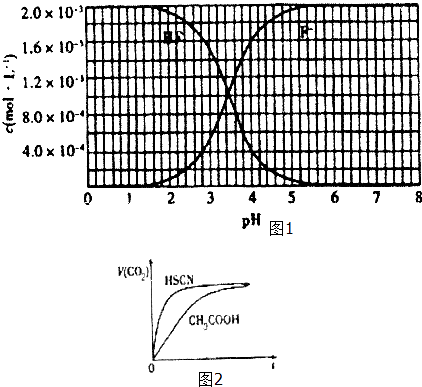
请根据以下信息回答下列问题:
(1)、25℃时,将20mL 0.10mol•L﹣1CH3COOH溶液和20mL 0.1 mol•L﹣1 HSCN溶液分别 与20mL 0.10mol•L﹣1NaHCO3 溶液混合,实验测得产生的气体体积(V)随时间(t)变化的示意图为图2所示:反应初始阶段,两种溶液产生CO2气体的速率存在明显差异的原因是 ,
反应结束后所得两溶液中,C(CH3COO﹣)c(SCN﹣)(填“>”、“<”或“=”)
(2)、25℃时,HF电离平衡常数的数值Ka≈ .(3)、4×10﹣3mol•L﹣1HF溶液与4×10﹣4mol•L﹣1CaCl2溶液等体积混合,调节混合液pH为4.0(忽略调节混合液体积的变化),通过列式计算说明是否有沉淀产生.
-
-