备考2018年高考化学二轮专题复习 专题九:化学反应速率与化学平衡
试卷更新日期:2018-03-07 类型:二轮复习
一、选择题
-
1. 一定温度下,在某容器中进行如下可逆反应,当混合气体的平均摩尔质量不再改变时,说明反应达到平衡状态的是 ( )
①恒容时发生反应:A(g)+B(g)⇌3C(g)
②恒压时发生反应:A(g)+B(g)⇌2C(g)
③恒容时发生反应:A(g)+2B(g)⇌2C(g)+D(g)
④恒压时发生反应:A(g)+2B(g)⇌3C(g)J﹣D(s)
A、②③ B、①④ C、①③ D、②④2. 下列说法正确的是( )A、增大体系压强,活化分子数增加,化学反应速率一定增大 B、加入反应物,使活化分子百分数增加,化学反应速率增大 C、活化分子间所发生的分子间的碰撞均为有效碰撞 D、升高温度,活化分子百分数增加,化学反应速率一定增大3. 已知反应①:CO(g)+CuO(s)⇌CO2(g)+Cu(s)和反应②:H2(g)+CuO(s)⇌Cu(s)+H2O(g)在相同温度下的平衡常数分别为K1和K2 , 该温度下反应③:CO(g)+H2O(g)⇌CO2(g)+H2(g)的平衡常数为K.则下列说法正确的是( )A、反应①的平衡常数K1= B、反应③的平衡常数K= C、对于反应③,恒容时,若温度升高,H2的浓度减小,则该反应的焓变为正值 D、对于反应②,恒温恒容时,若加入CuO,平衡向正向移动,H2的浓度减小4. 已知NO2和N2O4可以相互转化:2NO2(g)⇌N2O4(g)△H<0.在恒温条件下将一定量NO2和N2O4的混合气体通入一容积为2L的密闭容器中,反应物浓度随时间变化关系如图.下列说法不正确的是( )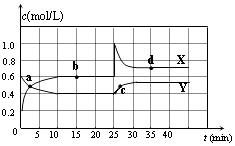 A、图中的两条曲线,X表示NO2浓度随时间的变化曲线 B、前10 min内用v(N2O4)=0.02 mol/(L•min) C、25 min时,NO2转变为N2O4的反应速率增大,其原 因是将密闭容器的体积缩小为1L D、该温度下反应的平衡常数 K=1.11 L/mol5. 在372K时,把0.5mol N2O4通入体积为5L的真空密闭容器中,立即出现红棕色.反应进行到2s时,NO2的浓度为 0.02mol•L﹣1 . 在60s时,体系已达平衡,此时容器内压强为开始时的1.6倍.下列说法正确的是( )A、前2s以N2O4的浓度变化表示的平均反应速率为0.01 mol•L﹣1•s﹣1 B、在2s时体系内压强为开始时的1.1倍 C、在平衡时体系内含有N2O40.25 mol D、平衡时,N2O4的转化率为40%6. 某密闭容器中,A(s)+3 B(g)⇌2 C(g)+D(g)△H>0在一定条件下达到平衡,下列说法正确的是( )A、加入少量A,B的转化率增大 B、升高温度,正反应速率增大,逆反应速率减小,平衡向正反应方向移动 C、增大压强,平衡不移动,正、逆反应速率不变 D、加入催化剂,反应速率增大,平衡常数不变7. 某温度下,在2L的密闭容器中,加入1molX(g)和2molY(g)发生反应:X(g)+mY(g)⇌3Z(g),平衡时,X,Y,Z的体积分数分别为30%、60%、10%,在此平衡体系中加入1molZ(g),再将达到平衡后,X,Y,Z的体积分数不变.下列叙述不正确的是( )A、m=2 B、两次平衡的平衡常数相同 C、X与Y的平衡转化率之比为1:1 D、第二次平衡时,Z的浓度为0.4mol•L﹣18. 硝酸生产中,500℃时,NH3和O2可能发生如下反应:
A、图中的两条曲线,X表示NO2浓度随时间的变化曲线 B、前10 min内用v(N2O4)=0.02 mol/(L•min) C、25 min时,NO2转变为N2O4的反应速率增大,其原 因是将密闭容器的体积缩小为1L D、该温度下反应的平衡常数 K=1.11 L/mol5. 在372K时,把0.5mol N2O4通入体积为5L的真空密闭容器中,立即出现红棕色.反应进行到2s时,NO2的浓度为 0.02mol•L﹣1 . 在60s时,体系已达平衡,此时容器内压强为开始时的1.6倍.下列说法正确的是( )A、前2s以N2O4的浓度变化表示的平均反应速率为0.01 mol•L﹣1•s﹣1 B、在2s时体系内压强为开始时的1.1倍 C、在平衡时体系内含有N2O40.25 mol D、平衡时,N2O4的转化率为40%6. 某密闭容器中,A(s)+3 B(g)⇌2 C(g)+D(g)△H>0在一定条件下达到平衡,下列说法正确的是( )A、加入少量A,B的转化率增大 B、升高温度,正反应速率增大,逆反应速率减小,平衡向正反应方向移动 C、增大压强,平衡不移动,正、逆反应速率不变 D、加入催化剂,反应速率增大,平衡常数不变7. 某温度下,在2L的密闭容器中,加入1molX(g)和2molY(g)发生反应:X(g)+mY(g)⇌3Z(g),平衡时,X,Y,Z的体积分数分别为30%、60%、10%,在此平衡体系中加入1molZ(g),再将达到平衡后,X,Y,Z的体积分数不变.下列叙述不正确的是( )A、m=2 B、两次平衡的平衡常数相同 C、X与Y的平衡转化率之比为1:1 D、第二次平衡时,Z的浓度为0.4mol•L﹣18. 硝酸生产中,500℃时,NH3和O2可能发生如下反应:①4NH3(g)+5O2(g)⇌4NO(g)+6H2O(g)+9072kJ/K=1.1×1026
②4NH3(g)+4O2(g)⇌2N2O(g)+6H2O(g)+1105kJ/K=4.4×1028
③4NH3(g)+3O2(g)⇌2N2(g)+6H2O(g)+1269kJ/K=7.1×1034
其中,②、③是副反应.若要减少副反应,提高NO的产率,最合理的措施是( )
A、减小压强 B、降低温度 C、增大O2浓度 D、使用合适的催化剂9. 在密闭容器中,一定条件下,进行如下反应:NO(g)+CO(g)⇌ N2(g)+CO2(g)△H=﹣373.2kJ/mol,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是( )A、加催化剂同时升高温度 B、加催化剂同时增大压强 C、升高温度同时充入N2 D、降低温度同时增大压强10. 一定温度下,在一容积不变的密闭容器中发生的可逆反应2X(g)⇌Y(g)+Z(s),以下不能作为反应达到平衡标志的是( )A、X的分解速率是Y的消耗速率的2倍 B、混合气体的压强不再变化 C、单位时间内生成1mol Y的同时分解2 mol X D、混合气体的密度不再变化11.将4 mol A气体和2 mol B气体在2 L的容器中混合并在一定条件下发生如下反应2A(g)+B(g)
 2C(g),若2 s(秒)后测得C的浓度为0.6 mol/L,现有下列几种说法:
2C(g),若2 s(秒)后测得C的浓度为0.6 mol/L,现有下列几种说法:
①用物质A表示反应的平均速率为0.3 mol/(L·s)
②用物质B表示反应的平均速率为0.6 mol/(L·s)
③2 s时物质A的转化率为70%
④2 s时物质B的浓度为0.7 mol/L
其中正确的是( )A、①③ B、①④ C、②③ D、③④12. 一定温度下,在一容积不变的密闭容器中,充入一定量HI气体,发生如下可逆反应:2HI(g)⇌H2(g)+I2(g)△H>0.下列说法正确的是( )A、若每消耗2n mol HI的同时生成n mol H2 , 表明该反应已达平衡 B、容器内的压强不发生变化,表明该反应已达平衡 C、平衡时,若其他条件不变,再充入一定量HI,重新达平衡后,I2的百分含量增大 D、平衡时,若其他条件不变,升高温度,混合气体的颜色加深13. 在一定条件下,反应X(g)+3Y(g)⇌2Z(g)△H=﹣92.4 kJ/mol,X的平衡转化率(α)与体系总压强(P)的关系如图所示.下列说法正确的是( ) A、图中A,B两点,达到相同的平衡体系 B、上述反应在达到平衡后,增大压强,H2的转化率提高 C、升高温度,平衡向逆反应方向移动,说明逆反应速率增大,正反应速率减小 D、将1.0 mol X、3.0 mol Y,置于1 L密闭容器中发生反应,放出的热量为92.4 kJ14. 一定温度下,向2L恒容容器中充入1molA和1molB,发生反应A(g)+B(g)=C(g)经过一段时间后达到平衡,反应过程中测定的部分数据如表.下对说法正确的是( )
A、图中A,B两点,达到相同的平衡体系 B、上述反应在达到平衡后,增大压强,H2的转化率提高 C、升高温度,平衡向逆反应方向移动,说明逆反应速率增大,正反应速率减小 D、将1.0 mol X、3.0 mol Y,置于1 L密闭容器中发生反应,放出的热量为92.4 kJ14. 一定温度下,向2L恒容容器中充入1molA和1molB,发生反应A(g)+B(g)=C(g)经过一段时间后达到平衡,反应过程中测定的部分数据如表.下对说法正确的是( )t/s
0
5
15
25
35
n(A)/mol
1.0
0.85
0.81
0.80
0.80
A、前 5 s 的平均反应速率v(A)=0.03 mol•L﹣1•s﹣1 B、正反应是吸热反应 C、保持温度不变,起始时向容器中充入2molC,达平衡时,C的转化率大于80% D、保持温度不变,起始时向容器中充入0.2molA,0.2molB´和1molC,反应达到平衡前v(正)<v(逆)15. 利用CO和H2在催化剂的作用下合成甲醇,发生的反应如下:CO(g)+2H2(g)═CH3OH(g).在体积一定的密闭容器中按物质的量之比1:2充入CO和H2 , 测得平衡混合物中CH3OH的体积分数在不同压强下随温度的变化如图所示.下列说法正确的是( )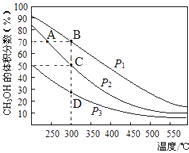 A、该反应的△H<0,且p1<p2 B、反应速率:ν逆(状态A)>ν逆(状态B) C、在C点时,CO转化率为75% D、在恒温恒压条件下向密闭容器中充入不同量的CH3OH,达平衡时CH3OH的体积分数也不同16. 在一定条件下,利用CO2合成CH3OH的反应如下:
A、该反应的△H<0,且p1<p2 B、反应速率:ν逆(状态A)>ν逆(状态B) C、在C点时,CO转化率为75% D、在恒温恒压条件下向密闭容器中充入不同量的CH3OH,达平衡时CH3OH的体积分数也不同16. 在一定条件下,利用CO2合成CH3OH的反应如下:CO2(g)+3H2(g)⇌H3OH(g)+H2O(g)△H1 ,
研究发现,反应过程中会有副反应:
CO2(g)+H2(g)⇌CO(g)+H2O(g)△H2 .
温度对CH3OH、CO的产率影响如图所示.下列说法中,不正确的是( )
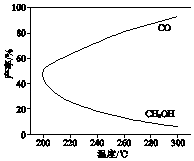 A、△H1<0,△H2>0 B、增大压强有利于加快合成反应的速率 C、生产过程中,温度越高越有利于提高CH3OH的产率 D、合成CH3OH反应的平衡常数表达式是K=17. 汽车尾气产生NO的反应为:N2(g)+O2(g)⇌2NO(g),一定条件下,等物质的量的N2(g)和O2(g)在恒容密闭容器中反应,如图曲线a表示该反应在温度T下N2的浓度随时间的变化,曲线b表示该反应在某一起始反应条件改变时N2的浓度随时间的变化.下列叙述正确的是( )
A、△H1<0,△H2>0 B、增大压强有利于加快合成反应的速率 C、生产过程中,温度越高越有利于提高CH3OH的产率 D、合成CH3OH反应的平衡常数表达式是K=17. 汽车尾气产生NO的反应为:N2(g)+O2(g)⇌2NO(g),一定条件下,等物质的量的N2(g)和O2(g)在恒容密闭容器中反应,如图曲线a表示该反应在温度T下N2的浓度随时间的变化,曲线b表示该反应在某一起始反应条件改变时N2的浓度随时间的变化.下列叙述正确的是( ) A、曲线b对应的条件改变可能是加入了催化剂 B、温度T下,随着反应的进行,混合气体的密度减小 C、温度T下,该反应的平衡常数K= D、若曲线b对应的条件改变是温度,可判断该反应是吸热反应
A、曲线b对应的条件改变可能是加入了催化剂 B、温度T下,随着反应的进行,混合气体的密度减小 C、温度T下,该反应的平衡常数K= D、若曲线b对应的条件改变是温度,可判断该反应是吸热反应二、综合题
-
18. 在一体积为10L的容器中,通入一定量的CO和H2O(g),在850℃时发生如下反应:CO(g)+H2O(g)⇌CO2(g)+H2(g).CO和H2O(g)浓度变化如图
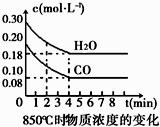 (1)、0~4min的平均反应速率v(CO)=mol•L﹣1•min﹣1 .(2)、该条件下,此反应的平衡常数K=(写表达式).(3)、该反应平衡时CO的转化率为 .(4)、能判断该反应达到化学平衡状态的依据是 .
(1)、0~4min的平均反应速率v(CO)=mol•L﹣1•min﹣1 .(2)、该条件下,此反应的平衡常数K=(写表达式).(3)、该反应平衡时CO的转化率为 .(4)、能判断该反应达到化学平衡状态的依据是 .A.容器中压强不变 B.混合气体中c(CO)不变
C.v(H2)正=v(H2O)逆 D.c(CO2)=c(CO)
若降低温度,该反应的K值将 , 该反应的化学反应速率将(填“增大”“减小”或“不变”).
(5)、t℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如表.时间(min)
CO
H2O
CO2
H2
0
0.200
0.300
0
0
2
0.138
0.238
0.062
0J062
3
c1
c2
c3
c3
4
c1
c2
c3
c3
5
0.116
0216
0.084
6
0.096
0.266
0.104
①c1数值 0.08mol•L﹣1(填大于、小于或等于).
②反应在4min~5min间,平衡向逆方向移动,可能的原因是 , 表中5min~6min之间数值发生变化,可能的原因是 .
a.增加水蒸气 b.降低温度 c.使用催化剂 d.增加氢气浓度.
19. 催化还原CO2是解决温室效应及能源问题的重要手段之一,研究表明,在Cu/ZnO催化剂存在下,CO2和H2可发生两个平行反应,分别生成CH3OH和CO,反应的热化学方程式如下:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)△H1=﹣53.7kJ•mol﹣1 Ⅰ
CO2(g)+H2(g)⇌CO(g)+H2O(g)△H2 Ⅱ
某实验室控制CO2和H2初始投料比为1:2.2,在相同压强下,经过相同反应时间测得如下实验数据:
T(K)
催化剂
CO2转化率(%)
甲醇选择性(%)
543
Cat.1
12.3
42.3
543
Cat.2
10.9
72.7
553
Cat.1
15.3
39.1
553
Cat.2
12.0
71.6
[备注]Cat.1:Cu/ZnO纳米棒;Cat.2:Cu/ZnO纳米片;甲醇选择性;转化的CO2中生成甲醇的百分比
已知:①CO和H2的标准燃烧热分别为﹣283.0kJ•mol﹣1和﹣285.8kJ•mol﹣1 .
②H2O(1)═H2O(g)△H3=44.0kJ•mol﹣1
请回答(不考虑温度对△H的影响):
(1)、反应I的平衡常数表达式K=;反应Ⅱ的△H2=kJ•mol﹣1 .(2)、有利于提高CO2转化为CH3OH平衡转化率的措施有 .A、使用催化剂Cat.1 B、使用催化剂Cat.2 C、降低反应温度 D、投料比不变,增加反应物的浓度 E、增大 CO2和H2的初始投料比(3)、表中实验数据表明,在相同温度下不同的催化剂对CO2转化成CH3OH的选择性有显著的影响,其原因是 .(4)、在如图中分别画出反应I在无催化剂、有Cat.1和有Cat.2三种情况下“反应过程﹣能量”示意图. (5)、研究证实,CO2也可在酸性水溶液中通过电解生成甲醇,则生成甲醇的反应发生在极,该电极反应式是 .20. 请运用化学反应原理的相关知识研究元素及其化合物的性质.
(5)、研究证实,CO2也可在酸性水溶液中通过电解生成甲醇,则生成甲醇的反应发生在极,该电极反应式是 .20. 请运用化学反应原理的相关知识研究元素及其化合物的性质.(1)工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为:
CO(g)+2H2(g)⇌CH3OH(g)△H1=﹣116KJ•mol﹣1
又知:CO(g)+O2(g)═CO2(g)△H2=﹣283KJ•mol﹣1
H2(g)+O2(g)═H2O(g)△H3=﹣242KJ•mol﹣1
H2(g)+ O2(g)═H2O(g)△H4=﹣286KJ•mol﹣1
则甲醇的燃烧热为 .
(2)T℃时,向2L密闭容器中充入4mol CO和6mol H2 , 5min后达平衡时CH3OH物质的量为2mol.该反应的速率v(H2)为 ;下列措施中有利于增大该反应的反应速率且提高转化率的是 .
a.随时将CH3OH与反应混合物分离
b.降低反应温度
c.使用高效催化剂
d.增大体系压强
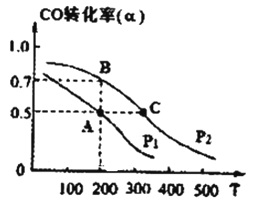
(3)在密闭容器中充有10mol CO与20mol H2 , 在催化剂作用下反应生成甲醇,CO的转化率(a)与温度(T)、压强(P)的关系如图所示.
①A、C两点都表示达到的平衡状态,则自反应开始到达平衡状态所需的时间,tA tc(填“大于”、“小于’’或“等于“).
②若A点时容器的体积为10L,该温度下B点的平衡常数K= .
(4)Na2SO3的水溶液呈 (填“酸”、“中”、‘‘碱”)性,原因是(用离子方程式表示): ;把CaCO3浊液滴入l.0mol/L的Na2SO3溶液中,能否产生CaSO3沉淀?若不能,说明原因;若可行,请简述判断依据及转化过程
(已知:Ksp(CaSO3)=1.4×10﹣7 , Ksp(CaCO3)=2.8×10﹣9).