备考2018年高考化学二轮专题复习 专题五:金属及其化合物
试卷更新日期:2018-03-07 类型:二轮复习
一、单选题
-
1. 化学知识在生产和生活中有着重要的应用.下列说法中不正确的是( )
①钠的还原性很强,可以置换出硫酸铜溶液中的铜单质
②氧化铝可制作耐火坩埚,只因为氧化铝的化学性质很稳定
③发酵粉中含有碳酸氢钠,能使焙制出的糕点疏松多孔
④Na2O2和Na2O均可作呼吸面具中O2的来源
⑤明矾常作为消毒剂
⑥碳酸钠在医疗上是治疗胃酸过多的一种药剂.
A、①②③④ B、①②④⑤ C、①②③④⑥ D、①②④⑤⑥2. “类推”这种思维方法在化学学习与研究中有时会产生错误结论,因此类推的结论最终要经过实践的检验,才能决定其正确与否,下列几种类推结论中错误的是( )①钠与水反应生成NaOH和H2 , 所有金属与水反应都生成碱和H2
②铁露置在空气中一段时间后就会生锈,性质更活泼的铝不能稳定存在于空气中
③Cu(OH)2受热易分解,Fe(OH)3受热也易分解
④Al(OH)3能与NaOH反应,Be(OH)2也能与NaOH反应.
A、①③ B、②④ C、①② D、①②④3. 下列关于物质或离子检验的叙述正确的是( )
A、在溶液中加KSCN,溶液显红色,证明原溶液中有Fe3+ , 无Fe2+ B、气体通过无水硫酸铜,粉末变蓝,证明原气体中含有水蒸气 C、灼烧白色粉末,火焰呈黄色,证明原粉末中有Na+ , 无K+ D、将气体通入澄清石灰水,溶液变浑浊,证明原气体是CO24. 下列关于铜的说法正确的是( )A、铜在干燥的空气中和在潮湿的空气中存在的形态相同 B、相同质量的铜分别与足量的氯气、硫完全反应,失去的电子数相同 C、相同物质的量的浓硫酸分别与足量的铜和氧化铜反应,生成硫酸铜的量相同 D、相同质量的铜分别与足量的稀硝酸、浓硝酸完全反应,生成气体的物质的量不同5. 在含FeCl3、FeCl2、AlCl3、NaCl的溶液中,加入足量的Na2O固体,在空气中充分搅拌反应后再加入过量的稀盐酸,溶液中离子数目变化最小的是( )A、Na+ B、Al3+ C、Fe3+ D、Fe2+6. 某研究小组通过实验探究Cu及其化合物的性质,操作正确且实验结论正确的是( )A、常温下将铜丝插入浓硫酸中,会产生有刺激性气味的气体,且溶液的变为蓝色 B、常温下将铜丝伸入盛满氯气的集气瓶中,观察CuCl2的生成 C、将CuCl2溶液在蒸发皿中加热蒸干,无法得到无水CuCl2固体 D、将表面有铜绿[Cu2(OH)2CO3]的铜器放入硝酸中浸泡,既除去铜绿,又不能损伤铜器7.已知A、B为单质,C为化合物:A+B
 C
C
 A+B.能实现上述转化关系的是( )
A+B.能实现上述转化关系的是( )①若C溶于水后得到强碱溶液,则A可能是Na
②若C的溶液遇Na2CO3 , 放出CO2气体,则A可能是H2
③若C的溶液中滴加KSCN溶液显红色,则B可能为Fe
④若C的溶液中滴加NaOH溶液有蓝色沉淀生成,则B可能为Cu.
A、①② B、②④ C、①③ D、③④8. 研究发现,硝酸越稀,还原产物中氮元素的化合价越低.某同学取适量的铁铝合金与足量很稀的硝酸充分反应,没有气体放出.在反应结束后的溶液中,逐滴加入4mol/L NaOH溶液,所加NaOH溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示.下列说法不正确的是( ) A、OC段离子反应方程式为H++OH﹣═H2O B、溶液中n(NH )=0.012 mol C、溶液中结合OH﹣能力最强的离子是H+ , 最弱的离子是Al3+ D、欲测定F点沉淀的质量,实验步骤是:过滤、洗涤、干燥、称量9. 下列物质之间的转化都一步能实现的是( )A、Si→SiO2→H2SiO3→Na2SiO3 B、Al→Al2O3→Al(OH)3→NaAlO2 C、Na→Na2O→Na2O2→NaOH→Na2CO3→NaHCO3 D、S→SO3→H2SO4→SO2→Na2SO3→Na2SO410. 用无机矿物资源生产部分材料,其生产流程如图.下列有关说法不正确的是( )
A、OC段离子反应方程式为H++OH﹣═H2O B、溶液中n(NH )=0.012 mol C、溶液中结合OH﹣能力最强的离子是H+ , 最弱的离子是Al3+ D、欲测定F点沉淀的质量,实验步骤是:过滤、洗涤、干燥、称量9. 下列物质之间的转化都一步能实现的是( )A、Si→SiO2→H2SiO3→Na2SiO3 B、Al→Al2O3→Al(OH)3→NaAlO2 C、Na→Na2O→Na2O2→NaOH→Na2CO3→NaHCO3 D、S→SO3→H2SO4→SO2→Na2SO3→Na2SO410. 用无机矿物资源生产部分材料,其生产流程如图.下列有关说法不正确的是( ) A、Al2O3、SiCl4均为共价化合物 B、生产过程中均涉及氧化还原反应 C、石英可用于制光导纤维,晶体Si常用做半导体材料 D、黄铜矿冶炼铜时产生的SO2可用于生产硫酸,FeO可用于冶炼铁
A、Al2O3、SiCl4均为共价化合物 B、生产过程中均涉及氧化还原反应 C、石英可用于制光导纤维,晶体Si常用做半导体材料 D、黄铜矿冶炼铜时产生的SO2可用于生产硫酸,FeO可用于冶炼铁二、填空题
-
11.
铁及其化合物在生产和生活中有广泛的应用.
(1)铁元素在元素周期表中的位置为 .
(2)等物质的量的铁分别与足量的盐酸、水蒸气在一定条件下反应,产生相同条件下的气体体积比为 ,铁在高温条件下与水蒸气反应的化学方程式为 .
(3)碱式硫酸铁[Fe(OH)SO4]是一种用于污水处理的新型高效絮凝剂,在医药上也可用于治疗消化性溃疡出血.工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁的工艺流程如图:

已知:常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
沉淀物
Fe3+
Fe2+
Al3+
开始沉淀
2.3
7.5
3.4
完全沉淀
3.2
9.7
4.4
①加入少量NaHCO3的目的是调节pH,应控制pH的范围为 .
②碱式硫酸铁溶于水后产生的[Fe(OH)2+]离子,可部分水解生成聚合离子[Fe2(OH)42+].该水解反应的离子方程式为 .
(4)高铁酸钾(K2FeO4)也是常用的水处理剂.它的制备方法有多种.
①熔融法又称为过氧化钠氧化法.先在高温熔融的条件下制备高铁酸钠:Fe+3Na2O2=Na2FeO4+2Na2O,再将高铁酸钠加入到氢氧化钾溶液里,发生反应:2KOH+Na2FeO4=K2FeO4+2NaOH,请根据复分解反应原理分析该反应发生的原因: .
②电解法制备高铁酸钾.铁和石墨分别做两个电极的电极材料,氢氧化钠溶液做电解液实现电解制备.阴极的电极材料为 , 写出阳极的电极反应式为 .
三、综合题
-
12. 氰化钠(NaCN)是一种重要化工原料,用于化学合成、电镀、冶金等方面.NaCN有剧毒,含氰废水需经无害化处理才能排放,某电镀厂含氰废水的一种工业处理流程如下:

已知:HCNO的结构式是:H﹣O﹣C≡N
HCN的Ka=6.02×10﹣10
[Ag(CN)2]﹣(aq)⇌Ag+(aq)+2CN﹣(aq) K=1.3×10﹣21
回答下列问题:
(1)、CN﹣中两原子均为8电子稳定结构,请写出CN﹣的电子式 .(2)、氰化钠遇水会产生剧毒氢氰酸,请写出相应的离子方程式 .(3)、向发生塔中通水蒸汽的目的是 .(4)、氧化池中氰化物的降解分两步进行CN﹣被氯气氧化成低毒的CNO﹣ , 写出相应的离子方程式 ,
CNO﹣被氯气氧化成无毒的两种气体,写出相应的离子方程式
(5)、贮水池中废水须先经碱化后再进行氧化的原因(6)、电镀厂电镀银时需要降低镀层金属的沉积速度,使镀层更加致密.电解液使用Na[Ag(CN)2],请写出阴极反应式 , 解释工业电镀中使用氰离子(CN﹣)的原因 .13. TiO2在工业生产和日常生活中有重要用途.(1)、工业上用钛铁矿石(FeTiO3 , 含FeO、Al2O3、SiO2等杂质)经过下述反应制得:
其中,步骤③发生的反应为:2H2SO4+FeTiO3=TiOSO4+FeSO4+2H2O.
(i)净化钛矿石时,需用浓氢氧化钠溶液来处理,写出该过程中两性氧化物发生反应的离子反应方程式: .
(ii)④中加入的X可能是
(iii)④⑤两步的目的是 .
(iv)写出⑥的化学反应方程式 .
(2)、TiO2可通过下述两种方法制备金属钛:方法一是先将TiO2与Cl2、C反应得到TiCl4 , 再用镁还原得到Ti.(i)写出生成TiCl4的化学反应方程式
方法二是电解TiO2来获得Ti(同时产生O2):
将处理过的TiO2作阴极,石墨为阳极,熔融CaO为电解液,用碳块作电解槽池.
(ii)阴极反应的电极反应式为 .
(iii)电解过程中需定期向电解槽池中加入碳块的原因是 .
14. 氯化亚铜(CuCl)常用作有机合成工业中的催化剂,在空气中迅速被氧化成绿色;见光则分解,变成褐色.如图是工业上用制作印刷电路的废液(含Fe3+、Cu2+、Fe2+、Cl﹣)生产CuCl的流程: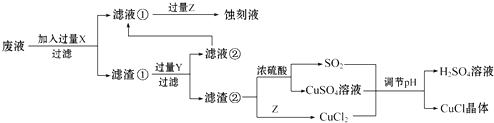
根据以上信息回答下列问题:
(1)、生产过程中X的化学式为 .(2)、写出产生CuCl的化学方程式: .(3)、在CuCl的生成过程中理论上不需要补充SO2气体,结合化学方程式和必要的文字说明理由 . 实际生产中SO2要适当过量,原因可能是(答一点即可).(4)、实验探究pH对CuCl产率的影响如下表所示:pH
1
2
3
4
5
6
7
CuCl产率/%
70
90
82
78
75
72
70
析出CuCl晶体最佳pH为 , 当pH较大时CuCl产率变低原因是 . 调节pH时,(填“能”或“不能”)用相同pH的硝酸代替硫酸,理由是 .
(5)、氯化亚铜的定量分析:①称取样品0.25g和过量的FeCl3溶液于锥形瓶中,充分溶解.
②用0.10mol•L﹣1硫酸铈标准溶液滴定.已知:CuCl+FeCl3═CuCl2+FeCl2、Fe2++Ce4+═Fe3++Ce3+ . 三次平行实验结果如下(平行实验结果相差不能超过1%):
平行实验次数
1
2
3
0.25g样品消耗硫酸铈标准溶液的体积(mL)
24.35
24.05
23.95
则样品中CuCl的纯度为(结果保留三位有效数字).
-