北京市石景山区2016-2017学年九年级化学一模考试试卷
试卷更新日期:2018-03-06 类型:中考模拟
一、单选题
-
1. 空气成分中,体积分数最大的是( )A、氮气 B、氧气 C、二氧化碳 D、稀有气体2. 下列物质中,属于纯净物的是( )A、空气 B、氯化钠溶液 C、二氧化碳 D、石灰石3. 下列物质在氧气中燃烧,产生大量白烟的是( )A、木炭 B、红磷 C、蜡烛 D、甲烷4. 水果散发出诱人的香味,你能闻到香味的原因是( )
 A、分子在不断运动 B、分子的质量很小 C、分子之间有间隔 D、分子的体积很小5. 下列物质属于氧化物的是( )A、H2CO3 B、O3 C、C2H5OH D、SiO26. 下列安全图标中,表示“禁止燃放鞭炮”的是( )A、
A、分子在不断运动 B、分子的质量很小 C、分子之间有间隔 D、分子的体积很小5. 下列物质属于氧化物的是( )A、H2CO3 B、O3 C、C2H5OH D、SiO26. 下列安全图标中,表示“禁止燃放鞭炮”的是( )A、
B、
B、
C、
C、
D、
D、
7. 下列方法能区分氧气和二氧化碳两瓶气体的是( )
7. 下列方法能区分氧气和二氧化碳两瓶气体的是( )
A、闻气味 B、观察颜色 C、倒入适量氢氧化钠溶液 D、将燃着的木条伸入集气瓶中8. 符号2N、N2、2CO、SO2 中,数字“2”能用来表示分子个数的是( )A、2N B、N2 C、2CO D、SO29. 次氯酸钠(NaClO)是消毒液的主要成分。NaClO中Cl元素的化合价为( )A、﹣2 B、﹣1 C、﹢1 D、﹢210. 钠的下列性质中,属于化学性质的是( )A、能与水反应 B、有延展性 C、硬度较小 D、密度较小11. 人体各处液体的pH:口腔为6.5~7.5,胃部为1.0~3.0,小肠为7.8-8.4,血液为7.35~7.45。其中碱性最强的部位是( )A、口腔 B、胃部 C、小肠 D、血液12. 下列物质必须密封保存的是( )A、氯化钠 B、浓盐酸 C、石灰石 D、木炭13. 下列物质的化学式书写不正确的是( )A、三氧化硫 SO3 B、氯化铁 FeCl3 C、硫酸钠 Na2SO4 D、氧化铝 AlO214. 下列实验操作中,不正确的是( )A、滴加液体药品 B、倾倒液体
B、倾倒液体  C、蒸发食盐水
C、蒸发食盐水  D、加热液体
D、加热液体  15. 在一定温度下,向100 g质量分数为20%的硝酸钾饱和溶液中加入2 g硝酸钾晶体,充分搅拌后,所得溶液中溶质质量分数为( )
15. 在一定温度下,向100 g质量分数为20%的硝酸钾饱和溶液中加入2 g硝酸钾晶体,充分搅拌后,所得溶液中溶质质量分数为( )
A、= 20% B、>20% C、<20% D、无法确定16. 下列实验方法一定能达到实验目的的是( )选项
实验目的
实验方法
A
除去粗盐中的难溶性杂质
将粗盐研碎、溶解、蒸发
B
除去铁制品上的铁锈
将铁制品长时间浸泡在足量的稀硫酸中
C
鉴别石灰水和NaOH溶液
加入适量的稀盐酸
D
检验某矿石中是否含碳酸盐
加入适量的稀盐酸,若产生气体再将气体通入澄清石灰水
A、A B、B C、C D、D17. 松花蛋是用料泥包裹鸭蛋加工而成,料泥是以生石灰、纯碱、食盐、草木灰为原料与水按比例混合制得,通过系列反应,产生的强碱(NaOH、KOH)渗入到蛋清和蛋黄中,使蛋白质分解、凝固并放出少量硫化氢气体和氨气(NH3),硫化氢与蛋清和蛋黄中的矿物质作用生成各种硫化物,使蛋清和蛋黄的颜色改变。下列说法不正确的是( )
A、强碱使蛋白质放出少量硫化氢气体和氨气的过程为化学变化 B、蛋白质中不含氮元素、含有硫元素 C、草木灰是制取KOH的原料之一 D、料泥制作过程中,通过化合反应和复分解反应产生氢氧化钠18. 如图为甲、乙、丙三种物质的溶解度曲线。下列说法正确的是( )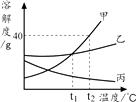 A、t2℃时,各取40 g于100 g水中,只有丙得到饱和溶液 B、t1℃时,甲、乙两种饱和溶液中溶质的质量相等 C、将甲的饱和溶液由t1℃升温至t2℃,溶质质量分数变大 D、t1℃时,加入丙物质可以将丙的不饱和溶液转化为饱和溶液19. 已知:CO + CuO Cu + CO2。若8 g CuO被CO完全反应,有关量的变化如下图,下列分析不正确的是( )
A、t2℃时,各取40 g于100 g水中,只有丙得到饱和溶液 B、t1℃时,甲、乙两种饱和溶液中溶质的质量相等 C、将甲的饱和溶液由t1℃升温至t2℃,溶质质量分数变大 D、t1℃时,加入丙物质可以将丙的不饱和溶液转化为饱和溶液19. 已知:CO + CuO Cu + CO2。若8 g CuO被CO完全反应,有关量的变化如下图,下列分析不正确的是( ) A、图中6.4表示生成Cu的质量 B、(8-6.4)表示消耗CO的质量 C、生成CO2的质量为4.4 g D、T2时CuO反应完
A、图中6.4表示生成Cu的质量 B、(8-6.4)表示消耗CO的质量 C、生成CO2的质量为4.4 g D、T2时CuO反应完二、填空题
-
20. 米、面、蔬菜、肉、植物油是烹饪食品时的主要原料。(1)、以上原料中富含蛋白质的是。(2)、大米、面粉等在温度和湿度较高的环境下容易滋生对人体有危害的_______(填序号)。A、黄曲霉素 B、甲醛 C、一氧化碳21. 请从A或B两题中任选1个作答,若两题均作答,A计分。
A
B


①钙咀嚼片中的钙是指(填“元素”“分子”或“单质”)。
②每片钙片中钙300 mg,请用计算式表示其计算过程。
①人体缺铁会引起。
⑤某成人按此说明书连续服药1天,可补充铁元素mg。
22. 空气是一种宝贵的自然资源,空气中各种成分作为原料广泛用于生产化肥、化工产品、炼钢、电光源等领域。其中生产化肥是以为原料。
23. 水是氢能的主要原料,利用太阳能和催化剂是分解水制取氢气的理想途径,写出反应的化学方程式。24. 化石燃料是一种不可再生资源,包括天然气、石油、。天然气主要成分燃烧时反应的化学方程式为。25. 地球上的金属资源大多以化合物的形式存在,还原法是冶炼金属的常用方法。请写出用一氧化碳从赤铁矿(主要成分为氧化铁)中冶炼铁的化学方程式。铁在自然环境中很容易生锈,请写出一种防止钢铁制品锈蚀的方法。26. 明明用“强力去油剂”(成分为氢氧化钠固体)进行油烟机的清洗。清洗过程为:①取“强力去油剂”200 g,加入1800 g的水,搅拌使其完全溶解;②将油烟机过滤网、油杯等部件放入配制好的溶液中浸泡30分钟;③进行清洗。
(1)、明明在使用“强力去油剂”配制溶液的过程中需要注意的事项是(写出一点即可)。(2)、明明配制的溶液中溶质质量分数为。(3)、“强力去油剂”必须密封保存,其原因是。27. 实践活动中,同学们用“锡纸”进行了如下两个实验。
(1)、将“锡纸”剪成一段两头宽中间窄的条状,将两头分别连接电池的正负极(造成短路),观察到“锡纸”立即燃烧。开始“锡纸”不燃烧,短路后能燃烧的原因是。(2)、将打磨后的“锡纸”放入盛有氯化锌溶液的试管中,观察到“锡纸”表面有深灰色固体析出。说明“锡纸”中的金属(填“是”或“不是”)锡。28. 醋和食盐是日常生活中必备调味品。(1)、食盐通过晾晒海水或煮盐井水、盐湖水再经过净化得到;醋通过大米、高粱等粮食发酵酿制而成。晾晒和发酵两种变化的本质区别是。(2)、醋的有效成分是乙酸(CH3COOH),也叫醋酸。正在服碳酸氢钠片、复方氢氧化铝等药品的人,不宜食用醋,原因是。29. 干黄花无毒,而鲜黄花有毒,是因为鲜黄花中含有秋水仙碱。纯秋水仙碱易溶于乙醇,在冷水中易溶、热水中难溶。 (1)、秋水仙碱的乙醇溶液中,溶剂是。(2)、秋水仙碱在水中的溶解度随温度升高而(填“增大”或“减小”)。30. 阅读下面科普短文。
(1)、秋水仙碱的乙醇溶液中,溶剂是。(2)、秋水仙碱在水中的溶解度随温度升高而(填“增大”或“减小”)。30. 阅读下面科普短文。随着国内轿车工业的迅急发展,人们每天坐在汽车里的时间越来越长,而车内的空气质量状况也成为影响健康的重要因素之一。
下图为中国科学院所属理化环境分析研究中心发布的《国内汽车空气质量报告》中的测试结果(选取使用年限不同的50款市场上常见的车型进行检测)。


这份空气质量报告,无疑为我们敲响了警钟。
车内空气污染到底来源于哪里?下表列举了车内空气污染的源头及主要污染物。
主要源头
主要污染物
源头一:车内配件、材料和装饰物
车内本身的各种配件和材料释放的有害气体;买车后进行装饰,装饰物释放的有害气体。
总挥发性有机物( TVOC),包括:甲醛(CH2O)、苯(C6H6)等
源头二:空调系统、死角腐物
空调系统内潮湿阴暗的角落,成为霉菌大量繁殖的温床;车厢角落遗落的食品容易腐烂发霉。
胺、烟碱、霉菌及繁殖产生的霉味气体等
源头三:发动机长时间运转
汽车发动机长时间运转产生的热量会增加车内污染物的挥发,发动机运转中也会产生有害物质。
CO、汽油挥发成分、胺、烟碱等
如何改善车内空气质量呢?下面是一些常见的做法。
① 开窗通风:通常情况下,开窗通风是改善车内空气质量最有效的方法。
② 臭氧消毒:通过臭氧的氧化性可以去除一部分有害气体。
③ 安装车载空气净化器:某品牌空气净化器的工作原理如下图所示,空气通过HEPA过滤材料,清理空气中的尘埃及细小颗粒物,再通过活性炭的协同作用,吸附异味;甲醛在蜂窝状高效催化剂的作用下和氧气反应转化为二氧化碳和水,具有不产生二次污染的优点。

为满足人们对健康生活的追求,提高人们的生活品质,一些新技术、新材料也会不断地优化和使用。
依据文章内容,回答下列问题。
(1)、车载空气净化器工作原理图中活性炭主要起过滤和作用。(2)、《国内汽车空气质量报告》中的测试结果给我们敲响了警钟,其原因是。(3)、甲醛在蜂窝状高效催化剂的作用下发生反应的化学方程式为。(4)、下列有关说法中,正确的是_______(填序号)。A、车内的配件和装饰是车内主要污染源之一 B、车辆越新,TVOC超标越严重 C、臭氧消毒是利用臭氧的物理性质(5)、请你写出一条保持车内空气清洁的方法。31. 自然界就是一个天然“工厂”。自然界中的物质循环,形成了自然界中物质的平衡。下图所示为自然界中碳循环的示意。 (1)、自然界中二氧化碳消耗最重要的途径是 。(2)、减少二氧化碳排放的最有效途径是。(3)、二氧化碳与氧气均是空气组成中的重要物质,但其化学性质不同,从微粒的角度解释其原因。32. 钢铁工业用到的酸洗液中硫酸含量在100~230 g/L,酸洗过程中,会产生大量的硫酸废液,下面是两种处理方法。
(1)、自然界中二氧化碳消耗最重要的途径是 。(2)、减少二氧化碳排放的最有效途径是。(3)、二氧化碳与氧气均是空气组成中的重要物质,但其化学性质不同,从微粒的角度解释其原因。32. 钢铁工业用到的酸洗液中硫酸含量在100~230 g/L,酸洗过程中,会产生大量的硫酸废液,下面是两种处理方法。
(1)、传统方法:用熟石灰进行中和处理,反应的化学方程式为。(2)、再生方法:酸洗过程中,当硫酸含量降到100 g/L,硫酸亚铁含量达250 g/L,可以对洗液进行再生。在洗液中加入浓硫酸将硫酸浓度调至230 g/L,再将温度降低到16℃左右,析出大量的硫酸亚铁晶体,分离后,洗液返回酸洗槽继续使用。① 16℃左右,析出硫酸亚铁晶体后的溶液是硫酸亚铁的(填“饱和”或“不饱和”)溶液。
② 再生的酸洗液中的溶质一定含有。
③ 洗液再生过程中,温度会升高,其原因是。
33. A~E五种物质分别由H、O、C、Cl、Ca五种元素中的两种或三种组成,请回答下列问题。
(1)、A物质是生石灰的主要成分,A的化学式为。(2)、B物质中两种元素的原子个数比为1:1,其分解时可以产生氧气,B为。(3)、向NaOH溶液依次加入C、D溶液、E溶液和紫色石蕊溶液,现象如下图所示。
① C和D两种物质分别是。
② 加入E后沉淀溶解并产生大量气泡,用化学方程式表示产生此现象的原因。
③ 红色溶液中含有的物质有水、石蕊、。
三、科学探究题
-
34. 为探究铁、铜、银三种金属的活动性顺序,设计了A、B两个方案。请从两个方案中任选1个作答,若两个均作答,按方案A计分。
方案A
方案B
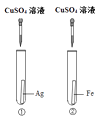

①实验中发生反应的化学方程式为。
②实验中观察到的现象是。
③该方案(填“能”或“不能”)验证三种金属的活动性。
①实验中发生反应的化学方程式为。
②实验中观察到的现象是。
③该方案(填“能”或“不能”)验证三种金属的活动性。
35. 实验小组同学用完全相同的4个充满二氧化碳的软塑料瓶验证二氧化碳的化学性质。实验
操作
现象
①
向瓶①内倒入1/3体积水,迅速拧紧瓶盖,振荡
瓶子均变瘪,变瘪程度依次为①<②<④<③
②
向瓶②内倒入1/3体积饱和石灰水,迅速拧紧瓶盖,振荡
③
向瓶③内倒入1/3体积5%氢氧化钠溶液,迅速拧紧瓶盖,振荡
④
向瓶④内倒入1/10体积氢氧化钠固体,迅速拧紧瓶盖,振荡
已知:通常状况下,1体积的水约能溶解1体积二氧化碳。
(1)、实验1中发生反应的化学方程式为;实验2中发生反应的化学方程式为。(2)、上述4个实验中,验证了CO2能与NaOH反应的实验有(填序号)。(3)、请判断实验1能否证明二氧化碳与水反应?并说明理由。36. 某小组同学用不同长度的光亮镁条分别与4 mL 5%的稀盐酸反应,实验现象记录如下。试管
A
B
C
D
镁条长度
1 cm
2 cm
3 cm
4 cm
实验现象
产生大量气泡,镁条溶解
无沉淀
少量灰白色沉淀
较多量灰白色沉淀
大量灰白色沉淀
【提出问题】灰白色沉淀是什么?实验中为什么出现了灰白色沉淀?
【查阅资料】氢氧化镁[Mg(OH)2]难溶于水,Mg(OH)2 MgO + H2O
【猜想与假设】
Ⅰ. 灰白色沉淀可能是析出的氯化镁。
Ⅱ. 灰白色沉淀可能是生成的氢氧化镁。
【进行实验】
实验
实验操作
实验现象
①
① 取一定量上述实验中灰白色沉淀放入试管中,然后加入 5mL 蒸馏水,振荡、静置
② 取等量氯化镁固体放入另一支试管中,加5mL蒸馏水,振荡
① 中固体量未减少
② 中固体全部溶解得到澄清溶液
②
取上述实验中灰白色沉淀,用蒸馏水洗涤、室温晾干,放入试管中进行加热,试管口用湿润的紫色石蕊试纸检验
紫色石蕊试纸变红
③
① 在1支试管放入一小段光亮的镁条,加入 5mL 蒸馏水
② 再向试管中加入几滴氯化镁饱和溶液
① 中无明显现象
② 中镁条表面立即持续产生细小气泡并不断溶解,一段时间后镁条全部溶解,有大量灰白色沉淀
实验4:测定反应过程中溶液的pH变化。
在小烧杯中放入约 50 mL 质量分数为0.5% 稀盐酸,然后加入10 cm 光亮的镁条,现象及数据如下表所示。
时间/min
0
48
77
85
87
95
100
溶液pH
2
3
5.2
7.2
8.6
9.1
10.6
实验现象

大量气泡
镁条表面变暗,气泡减小
镁条表面变灰,有沉淀生成,并逐渐增多
【解释与结论】
(1)、试管A中,镁与稀盐酸反应的化学方程式为。(2)、猜想与假设Ⅰ不成立,其原因是。(3)、根据上述实验得出的下列结论中,正确的是________(填序号)。A、灰白色固体不是氢氧化镁 B、镁条的用量偏多导致沉淀产生 C、灰白色固体受热产生酸性物质(4)、根据实验4,你认为产生灰白色沉淀的条件是。(5)、【反思与评价】经过进一步实验,灰白色沉淀中含有镁、氯、氢、氧四种元素。实验3中产生灰白色沉淀是因为镁与反应生成的。
(6)、通过本实验,今后再遇到化学反应中的异常现象时,可以从角度分析原因(答出一条即可)。