北京市平谷区2016-2017学年九年级化学一模考试试卷
试卷更新日期:2018-03-06 类型:中考模拟
一、单选题
-
1. 以下气体在自然界中能发生光合作用的是( )A、H2 B、O2 C、N2 D、CO22. 下列金属活动性最强的是( )A、Mg B、Ag C、Cu D、Zn3. 如图为空气成分示意图(按体积计算),其中“a”代表的是( )
 A、氧气 B、氮气 C、二氧化碳 D、稀有气体4. 每年5月31日为世界无烟日.吸烟有害健康,烟气中的一种有毒气体是( )A、O2 B、N2 C、CO D、CO25. 下列饮品属于溶液的是( )A、蔗糖水 B、牛奶 C、果粒橙 D、豆浆6. 氢氧化钠是重要的化工原料,其俗称是( )A、纯碱 B、烧碱 C、小苏打 D、熟石灰7. 小刚测定了下列4种日用品的pH,其中呈酸性的是( )
A、氧气 B、氮气 C、二氧化碳 D、稀有气体4. 每年5月31日为世界无烟日.吸烟有害健康,烟气中的一种有毒气体是( )A、O2 B、N2 C、CO D、CO25. 下列饮品属于溶液的是( )A、蔗糖水 B、牛奶 C、果粒橙 D、豆浆6. 氢氧化钠是重要的化工原料,其俗称是( )A、纯碱 B、烧碱 C、小苏打 D、熟石灰7. 小刚测定了下列4种日用品的pH,其中呈酸性的是( )日用品
A.洁厕灵
B.洗涤灵
C.洗发水
D.消毒液
pH
1
7
9
12
A、A B、B C、C D、D8. 下列物质必须密封保存的是( )
A、木炭 B、浓盐酸 C、石灰石 D、氯化钠9. 下列微粒中,能表示2个氢分子的是( )A、2H B、2H+ C、H2O D、2H210. 下列措施中,不能防止铁制品锈蚀的是( )A、喷漆 B、镀一层耐腐蚀的金属 C、制成不锈钢 D、存放在潮湿的空气中11. 下列生活中的做法,不利于节约用水的是( )A、用淘米水浇花 B、用洗过衣服的水冲马桶 C、隔夜的白开水直接倒掉 D、洗手打肥皂时暂时关闭水龙头12. 下列操作正确的是( )A、 点燃酒精灯
B、
点燃酒精灯
B、 稀释浓硫酸
C、
稀释浓硫酸
C、 装生锈铁钉
D、
装生锈铁钉
D、 倾倒稀硫酸
13. 图中是钠元素在元素周期表中的信息和钠原子结构示意图.下列说法错误的是( )
倾倒稀硫酸
13. 图中是钠元素在元素周期表中的信息和钠原子结构示意图.下列说法错误的是( ) A、钠的原子序数为11 B、钠原子核外有3个电子层 C、钠的相对原子质量为22.989 D、化学反应中,钠原子易得电子14. 下列方法能鉴别空气、氧气和二氧化碳三瓶气体的是( )A、闻气味 B、将集气瓶倒扣在水中 C、观察颜色 D、将燃着的木条伸入瓶中15. 下列物质的用途中,利用其物理性质的是( )
A、钠的原子序数为11 B、钠原子核外有3个电子层 C、钠的相对原子质量为22.989 D、化学反应中,钠原子易得电子14. 下列方法能鉴别空气、氧气和二氧化碳三瓶气体的是( )A、闻气味 B、将集气瓶倒扣在水中 C、观察颜色 D、将燃着的木条伸入瓶中15. 下列物质的用途中,利用其物理性质的是( )
A、氧气用于切割金属 B、干冰用于人工降雨 C、熟石灰用于改良土壤酸性 D、纯碱用于蒸馒头16. 甲和乙两种固态物质的饱和溶液中溶质质量分数与温度的关系如图8所示。下列说法不正确的是( ) A、甲和乙两种物质的溶解度随温度的升高而增大 B、t1℃时,甲和乙两种物质的溶解度相等 C、t1℃时,甲和乙两种物质溶液的溶质质量分数相等 D、25g乙物质完全溶于100g水中所需的最低温度是t2℃17. 用甲和乙反应制备燃料丙。根据下列微观示意图得出的结论中,正确的是( )
A、甲和乙两种物质的溶解度随温度的升高而增大 B、t1℃时,甲和乙两种物质的溶解度相等 C、t1℃时,甲和乙两种物质溶液的溶质质量分数相等 D、25g乙物质完全溶于100g水中所需的最低温度是t2℃17. 用甲和乙反应制备燃料丙。根据下列微观示意图得出的结论中,正确的是( ) A、甲的化学式为CH2 B、反应中甲、乙、丙的分子个数比为2:1:1 C、甲、乙、丙都是氧化物 D、乙中氢元素质量分数最低18. 实验操作能达到实验目的的是( )
A、甲的化学式为CH2 B、反应中甲、乙、丙的分子个数比为2:1:1 C、甲、乙、丙都是氧化物 D、乙中氢元素质量分数最低18. 实验操作能达到实验目的的是( )选项
实验目的
实验操作
A
验证氯化钠溶液中混有盐酸
取少量溶液,滴加无色酚酞溶液
B
比较Fe,Cu,Ag的金属活动性
铁丝浸入CuSO4溶液,铜丝浸入AgNO3溶液
C
除去铁制品上的铁锈
将铁制品长时间浸泡在足量的稀硫酸中
D
除去粗盐中的可溶性杂质
将粗盐研碎,溶解,蒸发
A、A B、B C、C D、D19. 钛在国防上有着很重要的用途。工业上常采用金属热还原法制金属钛:反应①将TiO2(或天然的金红石)和炭粉混合加热至1000~1100K,进行氯化处理,并使生成的TiCl4 , 蒸气冷凝TiO2+2C+2Cl2=TiCl4+2CO; ②在1070K用熔融的镁在氩气中还原TiCl4可得多孔的海绵钛:TiCl4+2Mg=2MgCl2+Ti。下列有关说法正确的是( )
A、冶炼过程对环境没有污染 B、反应①中只有氧元素化合价没有改变 C、反应②属于置换反应 D、金属Ti在加热时不易跟氧气反应20. 下列各图像能正确反映对应变化关系是( )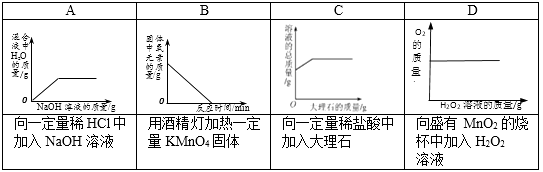 A、A B、B C、C D、D
A、A B、B C、C D、D二、填空题
-
21. “平谷桃花节”又到了,以下记录了雯雯游览的一天。请回答下列问题。(1)、早晨醒来她吃早餐。
①早餐食物中有花卷、牛奶、鸡蛋和苹果,其中富含维生素的是。
②牛奶中含有丰富的钙元素,如果缺乏会引起。
(2)、她出发了。①她携带的物品中,主要材料属于有机合成材料的是(填字母序号)。


②背包中她还携带了治疗胃酸过多的药物小苏打,写出小苏打与胃酸反应的化学方程式。
(3)、在路上,她发现我市正大力推行“清洁能源”工程。①煤改气是指将传统的燃煤改成燃烧天然气,天然气的主要成分是甲烷,甲烷燃烧的化学方程式为 , 天然气、煤、统称为化石燃料。
②为保护环境防治雾霾,我市大力推动清洁能源的发展。以下为清洁能源的是。
 (4)、走进平谷的万亩桃花林中,她闻到了阵阵花香,是因为分子。(5)、她在游览时自带的水喝完了,她在路边发现了一条小河河水很浑浊而河边的一个小水坑里的水却很清澈。小河与水坑之间的砂石的作用是 , 她想到了用如图所示自制净水器来净化小坑里的水,其中活性炭的作用是。她又联想起电解水实验,反应的化学方程式为。
(4)、走进平谷的万亩桃花林中,她闻到了阵阵花香,是因为分子。(5)、她在游览时自带的水喝完了,她在路边发现了一条小河河水很浑浊而河边的一个小水坑里的水却很清澈。小河与水坑之间的砂石的作用是 , 她想到了用如图所示自制净水器来净化小坑里的水,其中活性炭的作用是。她又联想起电解水实验,反应的化学方程式为。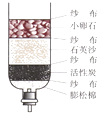 (6)、她走进景区。游览了著名的天云山玻璃栈道,锻炼了胆量。玻璃的主要成分是SiO2 , 其中Si元素的化合价为。(7)、在游览中她看到了一座铁索桥。
(6)、她走进景区。游览了著名的天云山玻璃栈道,锻炼了胆量。玻璃的主要成分是SiO2 , 其中Si元素的化合价为。(7)、在游览中她看到了一座铁索桥。①联系所学金属冶炼的知识,提出了下列问题:
工业上用一氧化碳和赤铁矿炼铁的原理是(写化学方程式)。
建造这座桥大约用了112吨铁,理论需要氧化铁吨。
②走过铁索桥后她发现有位游客不小心擦伤了手,她赶快拿出自带的碘酒帮其消毒。碘酒是将碘溶解在酒精中制得碘的酒精溶液,碘酒中的溶剂是。
(8)、临近中午她饿了,她打开了自带的即热饭盒,其内部结构如图所示。需要加热食物时,让盒内的水与生石灰接触即可,此反应的化学方程式为。 (9)、游玩归来,她看新闻。
(9)、游玩归来,她看新闻。使用尿素处理尾气可使重型柴油车达到国IV排放标准。其原理是尿素[CO(NH2)2]与汽车尾气中的氮氧化物(如二氧化氮)反应,生成无污染的气体排出。
①尿素属于肥。
②尿素中碳氢元素质量比:。
③补全尿素与二氧化氮反应的化学方程式:4 CO(NH2)2 + 6NO2 4CO2 + 8H2O + 。
22. 科学实践活动课上,同学们在老师的指导下表演了魔术。先向烧杯中倒入无水乙醇,将布手帕放入其中,完全浸透,取出手帕,轻轻挤干,用镊子夹住,从下方点燃,片刻后,手帕烧成灰烬(如图1所示)。之后,再向另一只烧杯中倒入白酒,取另一块材质、大小完全相同的手帕重复上述操作,火焰熄灭后,手帕依然完好如初(如图2所示)。已知:白酒由乙醇和水组成。
 (1)、白酒属于(填“混合物”或“纯净物”)。(2)、布手帕“烧不坏”的原因有 。(3)、实验过程中运用了的研究方法。23. 阅读下面科普短文(原文作者:龙门、宋野等,原文有删改)
(1)、白酒属于(填“混合物”或“纯净物”)。(2)、布手帕“烧不坏”的原因有 。(3)、实验过程中运用了的研究方法。23. 阅读下面科普短文(原文作者:龙门、宋野等,原文有删改)咸鸭蛋是人们常用的一种食品,咸鸭蛋黄还是制作粽子、点心等食品的材料。咸鸭蛋中富含锌、钙,对儿童身体及骨骼的生长有帮助,并能在一定程度上预防贫血。
资料1:腌制原理
咸鸭蛋在腌制过程中,食盐通过蛋壳及蛋壳膜不断向蛋内渗透,虽然没有改变蛋白质及脂肪的成分,但却改变了蛋白中蛋白质的特性及蛋黄中脂质含量。
资料2:腌制过程
腌制鸭蛋一般经过以下几个步骤:鲜蛋→检验(照蛋)→洗蛋→晾干→放入食盐水溶液中装罐→腌制。一般腌制30天,就能得到味美的咸鸭蛋。资料显示,将晾干后的鲜鸭蛋放入1%的盐酸溶液中浸泡10分钟,蛋壳(主要成分是CaCO3)与盐酸溶液发生反应,蛋壳表面的毛孔增大。放入饱和的食盐水中,溶液更易通过蛋膜进入蛋清,只需7天左右就可腌制出合格的咸蛋(蛋内的食盐含量及蛋黄内的油脂含量均达到国家标准),且口感很好。
资料3:影响咸鸭蛋品质的因素
咸鸭蛋的蛋黄指数是鸭蛋品质的一个重要指标。一般情况下,蛋黄指数越高,品质越好。不同腌制条件对蛋黄指数的影响如下所示。
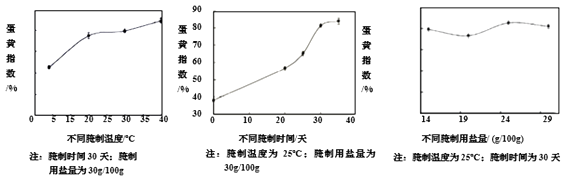
资料4:咸鸭蛋的食用
咸鸭蛋与鲜蛋的营养价值基本相同,但咸鸭蛋中钠、钙、铁、硒等矿物质元素含量比鲜鸭蛋高。特别是含钠量高,折算成含盐量,每只咸蛋含盐在6g以上。长期高盐摄取是造成高血压、胃粘膜受损等疾病的原因。
依据文章内容,回答下列问题。
(1)、鲜鸭蛋及咸鸭蛋中均含锌、钙,“锌”“钙”指的是(填“分子”、“原子”或“元素”)。(2)、请写出蛋壳和盐酸反应的化学方程式。(3)、影响咸鸭蛋品质的因素有。(4)、当腌制温度为25℃、腌制时间为30天时,用盐量为g/(100g),咸鸭蛋品质最高。(5)、请写出一条食用咸鸭蛋的建议。24. 回收利用是保护金属资源的一条有效途径。某工业废料含氧化铜和氧化铁,经过处理后可得到铜和硫酸亚铁溶液,主要流程如下。已知:CuO + H2SO4 = Cu SO4 + HO ; Fe + Fe2(SO4)3 = 3Fe SO4
 (1)、写出过程Ⅲ的化学方程式是。(2)、A~F中,含铁元素的有(填字母序号): 。25. 某化学兴趣小组同学制作了一副化学扑克牌,每张牌中含有一种物质。下图是其中的9张牌,请根据9张牌完成下列问题。
(1)、写出过程Ⅲ的化学方程式是。(2)、A~F中,含铁元素的有(填字母序号): 。25. 某化学兴趣小组同学制作了一副化学扑克牌,每张牌中含有一种物质。下图是其中的9张牌,请根据9张牌完成下列问题。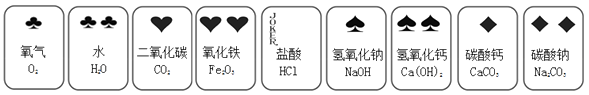 (1)、9种物质中属于单质的是。(2)、进行游戏。
(1)、9种物质中属于单质的是。(2)、进行游戏。游戏规则:依据问题,进行抢答。
①若两张牌上的物质反应后溶液变为黄色,则该反应的化学方程式是。
②上述9张牌中除水外的另外8种物质都能转化生成水,写出化合反应转化生成水的化学方程式是。
(3)、“九宫格”起源于河图洛书,是中国古代流传下来的神秘图案。将9张牌排列成如下“九宫格”,其相邻的任何两种物质间均能发生反应或转化,若“九宫格”中的2、4、6和8四张牌分别代表Na2CO3 、CO2 、Ca(OH)2 、Fe2O3 , 则1、3、5、7、9五张牌分别代表。 26. 实验课上,同学们配制100g质量分数为10%的氢氧化钠溶液做中和反应的实验,下图是配制该溶液的实验操作。
26. 实验课上,同学们配制100g质量分数为10%的氢氧化钠溶液做中和反应的实验,下图是配制该溶液的实验操作。 (1)、操作①中,需称量氢氧化钠固体的质量是g。(2)、用图①装置称量氢氧化钠固体,正确的操作是________(填序号)。A、直接放在托盘上称量。 B、在两个托盘上各放一张大小相同的同种纸,将氢氧化钠固体放在左盘纸上称量。 C、先称量一个小烧杯质量,再将氢氧化钠固体放入后称量总质量。(3)、操作②中,玻璃棒的作用是;在量取蒸馏水读数时,视线如图所示(其他操作正确),会造成所配制溶液的溶质质量分数(填“偏大”、“偏小”、“无影响”)。
(1)、操作①中,需称量氢氧化钠固体的质量是g。(2)、用图①装置称量氢氧化钠固体,正确的操作是________(填序号)。A、直接放在托盘上称量。 B、在两个托盘上各放一张大小相同的同种纸,将氢氧化钠固体放在左盘纸上称量。 C、先称量一个小烧杯质量,再将氢氧化钠固体放入后称量总质量。(3)、操作②中,玻璃棒的作用是;在量取蒸馏水读数时,视线如图所示(其他操作正确),会造成所配制溶液的溶质质量分数(填“偏大”、“偏小”、“无影响”)。 27. 根据下图所示实验,回答问题。
27. 根据下图所示实验,回答问题。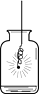

实验1:铁丝在氧气中燃烧
实验2:倾倒二氧化碳
(1)、实验1中反应的化学方程式为。(2)、实验2中的现象说明二氧化碳具有_____________性质。A、不能燃烧 B、不能支持燃烧 C、能溶于水 D、密度比空气大28. 元旦联欢会上,雯雯做了一个趣味实验“柠檬酸遇到洗衣粉”。资料:柠檬酸是柠檬中富含的一种有机酸。洗衣粉的成分中含有碳酸钠。
 (1)、她取少量洗衣粉于烧杯中,加入蒸馏水充分溶解,再加入1-2酚酞溶液变红色,则溶液显性。(2)、她取过量的柠檬酸溶液直接加入烧杯的洗衣粉水混合液中,观察到的现象是。
(1)、她取少量洗衣粉于烧杯中,加入蒸馏水充分溶解,再加入1-2酚酞溶液变红色,则溶液显性。(2)、她取过量的柠檬酸溶液直接加入烧杯的洗衣粉水混合液中,观察到的现象是。三、简答题
-
29. 工业上用黄铁矿(主要成分是FeS2)制备硫酸,主要流程如下:
 (1)、向沸腾炉中加入黄铁矿时需要将矿石粉碎,目的是。(2)、吸收塔中生成硫酸的化学方程式为。(3)、接触室中化合价发生改变的元素有。
(1)、向沸腾炉中加入黄铁矿时需要将矿石粉碎,目的是。(2)、吸收塔中生成硫酸的化学方程式为。(3)、接触室中化合价发生改变的元素有。四、实验探究题
-
30. 根据下图回答问题。
 (1)、仪器a的名称是。(2)、实验室用高锰酸钾制取氧气的化学方程式为。(3)、实验室制取二氧化碳气体,可选用的发生装置是(填字母序号)。(4)、加热高锰酸钾制氧气用装置E收集氧气时,下列实验操作不正确的是(填序号)。
(1)、仪器a的名称是。(2)、实验室用高锰酸钾制取氧气的化学方程式为。(3)、实验室制取二氧化碳气体,可选用的发生装置是(填字母序号)。(4)、加热高锰酸钾制氧气用装置E收集氧气时,下列实验操作不正确的是(填序号)。a.加热前,将集气瓶装满水,用玻璃片盖住瓶口,倒立在盛水的水槽中
b.加热后,观察到水中导管口开始有气泡时,立即收集气体
c.待集气瓶里的水排完后,在水面下用玻璃片盖住瓶口,移出水槽正放在桌面上
d.待收集氧气完毕后,先将酒精灯熄灭,再将导管移出水面。
五、科学探究题
-
31. 用如图所示装置,在常温下,分别进行研究空气中氧气含量和研究燃烧条件的实验。
已知:白磷的着火点为 40℃。
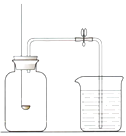
内容
【实验 1】测定空气中氧气含量
【实验 2】研究燃烧条件
实验步骤
燃烧匙中放足量白磷,烧杯中盛放足量水,用激光手电照射白磷,白磷燃烧起来。待白磷熄灭冷却至室温后,打开弹簧夹,观察到
________。
向广口瓶中加入少量二氧化锰,烧杯中盛有 80℃的热水,
在烧杯中导管口放置一小块白磷,塞紧瓶塞用注射器向瓶中注入适量H2 O2 溶液
(1)、实验前检查装置气密性:打开弹簧夹,向烧杯中加水至液面浸没下端导管口,用手捂住广口瓶瓶外壁,说明装置的气密性良好的现象是。(2)、补全实验1中的实验现象。(3)、实验2中,推入 H2O2 溶液后,瓶内发生反应的化学方程式为 , 实验过程中,能说明可燃物燃烧需要氧气的实验现象是。32. 铜片在潮湿的空气中久置,表面会产生绿色的铜锈。某小组同学设计并进行实验,探究铜生锈的条件。【查阅资料】常温下,亚硫酸钠(Na2SO3)可与O2发生化合反应。
【猜想与假设】常温下,铜生锈可能与O2、CO2、水蒸气有关。
【进行实验】通过控制与铜片接触的物质,利用如图装置(铜片长度为3 cm,试管容积为20 mL)分别进行下列5个实验,并持续观察30天。
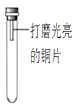
编号
主要实验操作
实验现象
①
先充满用NaOH浓溶液洗涤过的空气
再加入2 mL浓硫酸
铜片始终无明显变化
②
先加入4 mL饱和Na2SO3溶液
再充满CO2
铜片始终无明显变化
③
加入2 mL NaOH浓溶液
铜片始终无明显变化
④
先加入2 mL浓硫酸
再通入约4 mL CO2
铜片始终无明显变化
⑤
先加入2 mL蒸馏水
再通入约4 mL CO2
铜片表面变成绿色
【解释与结论】
(1)、实验中,NaOH浓溶液的作用是(用化学方程式表示)。(2)、实验1的目的是。(3)、实验2中,试管内的气体主要含有CO2、。(4)、得出“铜生锈一定与H2O有关”的结论,依据的两个实验是(填编号)。(5)、由上述实验可推知,铜片生锈的条件是。(6)、【反思与评价】在猜想与假设时,同学们认为铜生锈与N2无关,其理由是。
(7)、兴趣小组的同学认为不需进行上述实验,他们向铜锈中加入稀盐酸并把的气体通入澄清的石灰水变浑浊,即可得出铜生锈与空气中的二氧化碳有关。他们的依据是。
-
-