江西省高安市2016-2017学年九年级化学一模考试试卷
试卷更新日期:2018-03-01 类型:中考模拟
一、单选题
-
1. 下列我国古代的技术应用不涉及化学变化的是( )A、
 酿酒
B、
酿酒
B、 织布
C、
织布
C、 火药应用
D、
火药应用
D、 瓷器烧制
2. 下列气体在食品包装中常用做防腐的是( )
瓷器烧制
2. 下列气体在食品包装中常用做防腐的是( )
A、氮气 B、氧气 C、空气 D、水蒸气3. 预防甲状腺肿大(大脖子病)需适量补充的元素是( )
A、氟 B、铁 C、碘 D、硒4. 下列实验操作正确的是( )
A、 闻气味
B、
闻气味
B、 振荡试管
C、
振荡试管
C、 贮存气体
D、
贮存气体
D、 倾倒液体
5. 高安炒粉营养美味,下列用到的食材中富含蛋白质的是( )A、米粉 B、青菜 C、瘦猪肉 D、花生油6. 已知某种碳原子可用于测定文物的年代,该原子的原子核内含有6个质子和8个中子,则该原子的核外电子数为( )A、2 B、6 C、8 D、147. 最近,一则关于环保人士在公路边拾到30年前生产的食品包装袋的报道,再次引起了人们对垃圾处理的高度管制,以下垃圾处理方法中不合理的是( )
倾倒液体
5. 高安炒粉营养美味,下列用到的食材中富含蛋白质的是( )A、米粉 B、青菜 C、瘦猪肉 D、花生油6. 已知某种碳原子可用于测定文物的年代,该原子的原子核内含有6个质子和8个中子,则该原子的核外电子数为( )A、2 B、6 C、8 D、147. 最近,一则关于环保人士在公路边拾到30年前生产的食品包装袋的报道,再次引起了人们对垃圾处理的高度管制,以下垃圾处理方法中不合理的是( )
A、随地填埋 B、分类回收 C、焚烧发电 D、生物降解8. 下列四个实验中只需要完成三个就可以证明Zn、Cu、Ag三种金属的活动性顺序,其中不必进行的实验是( )A、将锌片放入稀硫酸 B、将铜片放入稀硫酸 C、将铜片放入硝酸银溶液 D、将锌片放入硝酸银溶液9. 在氯化钡溶液中滴入某种液体,生成白色沉淀。有关说法错误的是( )A、滴入的可能是硝酸银溶液 B、反应后溶液可能呈酸性 C、白色沉淀可能溶于盐酸 D、该反应可能是中和反应10. 在一定质量的甲溶液中逐渐加入乙物质至过量,反应过程中溶液的总质量与加入乙的质量的关系与如图曲线相符的是 ( )
序号
甲
乙
A
CuSO4溶液
铁粉
B
H2SO4溶液
锌粒
C
HCl溶液
NaOH溶液
D
CaCl2溶液
Na2CO3溶液
A、A B、B C、C D、D二、填空题
-
11. 下述描述生活中物质化学性质的是 ()
A.瓷碗易碎 B.轮胎能炸 C.饭菜会馊 D.
12. 江西省启动万家屋顶光伏发电示范工程,助推新能源产业。下列属于新能源的是()A.煤 B. 石油 C.风能 D.
13. 如图所示向试管里的水中加入某固体物质后,原来U型管内两端在同一水平上的红墨水,出现右边液面升高,左边的液面下降的现象,则原所加入固体可能是()
A.氢氧化钠 B.碳酸钙
C.硝酸铵 D.
14. 中国药学家屠呦呦因发现青蒿素而获得诺贝尔奖,青篙素(化学式为C15H22O5)是治疗疟疾的特效药。关于青篙素的说法正确的是()A.由C,H,O三种元素组成 B.属于氧化物
C.相对分子质量为282g D.其中质量分数最大的元素是(填元素名称)
15. 甲、乙两种物质的溶解度曲线如图所示。下列说法中正确的是()
A.t1℃时,甲饱和溶液的溶质质量分数大于乙饱和溶液
B. t2℃时,质量相同的甲、乙饱和溶液分别升温至t3℃,为达饱和状态,需加入甲的质量大于乙
C. t2℃时,甲、乙的饱和溶液分别降温至t1℃,甲溶液饱和,乙溶液不饱和
D. t2℃时,甲、乙饱和溶液的溶质质量分数都为
16. 用恰当的化学用语表示下列加点的文字部分:(1)、庐山瀑布的主要成分是水 ;(2)、金山金矿含有金元素;(3)、婺源辣椒中含辣椒碱,碱溶液中含有的阴离子;(4)、丰城煤矿的煤燃烧产生的二氧化硫中硫显+4价。17. 水与人类的生活和生产密切相关。请回答下列问题:(1)、人们对水组成的认识是从氢气在氧气中燃烧实验开始的,该反应的化学方程式;(2)、2016年“中国水周”活动的宣传主题为“落实五大发展理念,推进最严格水资源管理”。①打井取用地下水,检验地下水是否为硬水可用 , 生活中降低水的硬度的方法是;
②取用浑浊的河水,加入明矾处理后,再用活性炭除去水中的异味和色素。其中利用了活性炭的性;
③干旱地区容易发生火灾。消防员利用高压水枪灭火的原理是。
18. 2016年10月,神舟十一号与天宫二号对接成功。(1)、神舟十一号飞船的“空气”中能供给呼吸的气体是_______(填字母);A、氮气 B、氧气 C、水蒸气 D、二氧化碳(2)、铝锂合金是制造天宫二号的主要材料。①图1是铝在元素周期表中的信息以及原子结构示意图。铝元素的相对原子质量为 ;

②图2中的四种粒子的化学性质与铝原子相似的是(填字母,下同),它们表示的元素与铝元素同一周期的是;
③工业上用电解熔融的方法冶炼铝,化学方程式为:2X 4Al + 3O2↑,则X的化学式为。
19. 为减少污染并变废为宝,某化学小组在实验室探究工业废水的综合利用,设计了以下流程图并完成了回收铜和硫酸锌的实验.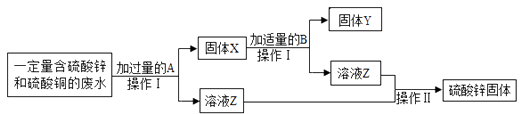 (1)、操作Ⅰ的名称是 , 操作Ⅱ中玻璃棒的作用是;(2)、X的成分为;(3)、加入B时反应的化学方程式为;(4)、理论上所得硫酸锌晶体的质量(填“>”“<”或“=”)原废液中硫酸锌的质量.20. A—F是初中化学常见的六种物质,其中B常温下是一种常见的气体,E是世界年产量最大的金属,F是一种红色单质。物质间的转化关系如图(图中“→”表示转化关系,“﹣”表示相互能反应,部分反应物、生成物及反应条件已略去)。
(1)、操作Ⅰ的名称是 , 操作Ⅱ中玻璃棒的作用是;(2)、X的成分为;(3)、加入B时反应的化学方程式为;(4)、理论上所得硫酸锌晶体的质量(填“>”“<”或“=”)原废液中硫酸锌的质量.20. A—F是初中化学常见的六种物质,其中B常温下是一种常见的气体,E是世界年产量最大的金属,F是一种红色单质。物质间的转化关系如图(图中“→”表示转化关系,“﹣”表示相互能反应,部分反应物、生成物及反应条件已略去)。
请回答:
(1)、物质E是 ;(2)、转化的化学方程式可能是;(3)、若A、D是单质,请写出反应④的化学反应现象为;(4)、若A是气体,C是常见的建筑材料,D物质类别属于。(填“氧化物”、“酸”、“碱”或“盐”)21.利用表中装置进行下列实验。已知:白磷的着火点为40℃。
实验装置 实验1 实验2 
I.将盛有足量锌粒的燃烧匙伸入瓶中,塞紧瓶塞
II.打开K,从长颈漏斗向瓶内加入稀盐酸,至浸没锌粒
II.当瓶中产生大量气泡时,关闭KI.将盛有白磷的燃烧匙伸入瓶内,塞紧瓶塞
II.打开K,从长颈漏斗向瓶内加入约80℃的热水,至浸没白磷
III.从a口向瓶中鼓入空气,使瓶中液面低于燃烧匙底部,关闭K(1)、连接仪器后,关闭K,加水至长颈漏斗内液面高于瓶中液面。一段时间后,液面高度保持不变,该现象说明。(2)、实验Ⅰ中,瓶内发生反应的化学方程式为;步骤Ⅲ中,关闭K后的现象是。(3)、实验2中,仅对比步骤Ⅱ和Ⅲ可知,欲探究的燃烧条件是。三、实验探究题
-
22. 根据下图装置,回答下列有关问题:
 (1)、装置图中仪器a的名称为;(2)、采用加热氯酸钾和二氧化锰的混合物制取较纯净的氧气,可选用的发生装置和收集装置的组合是 , 反应方程式为: ;(3)、制取二氧化碳最好选用的发生装置是 , 该装置与另一个可选用的装置相比,其主要优点是。检验该气体收集满的方法是;(4)、若用G装置采用排空法收集氢气,氢气应从(选“b”或“c”)进。
(1)、装置图中仪器a的名称为;(2)、采用加热氯酸钾和二氧化锰的混合物制取较纯净的氧气,可选用的发生装置和收集装置的组合是 , 反应方程式为: ;(3)、制取二氧化碳最好选用的发生装置是 , 该装置与另一个可选用的装置相比,其主要优点是。检验该气体收集满的方法是;(4)、若用G装置采用排空法收集氢气,氢气应从(选“b”或“c”)进。四、科学探究题
-
23. 在学习盐酸的化学性质时,小红、芳芳两位同学分别作了碳酸钠溶液和稀盐酸反应的实验如图所示。
 (1)、【实验现象】小红在实验中观察到有气泡冒出,而芳芳所做的实验无现象。写出小红实验的化学反应方程式 :。
(1)、【实验现象】小红在实验中观察到有气泡冒出,而芳芳所做的实验无现象。写出小红实验的化学反应方程式 :。
(2)、【实验讨论】芳芳同学的试验为什么观察不到有气泡?反应后溶液的溶质有哪些?
【查阅资料】①碳酸钠和稀盐酸反应生成物受到盐酸的质
量影响,稀盐酸过量生成二氧化碳,若盐酸量不足则生成碳酸氢钠;②碳酸氢钠与氯化钙溶液混合不发生反应,而碳酸钠和氯化钙溶液反应生成沉淀,且碳酸钠和碳酸氢钠溶液都呈碱性,氯化钙溶液呈中性。
【猜想与假设】实验反应后溶液中溶质可能有:①NaHCO3、NaCl、Na2CO3; ②NaHCO3、NaCl;
③NaHCO3、NaCl、HCl。
芳芳同学认为猜想③肯定不成立,理由是。
(3)、【实验设计】确定芳芳同学实验是否生成碳酸氢钠,并证明反应后的产物。实验步骤
实验现象
实验结论
A、取上述溶液少量于试管中,加
入足量的溶液。
产生白色沉淀
猜想①正确
B、取步骤A所得上层清液少量,滴加 溶液。
(4)、【实验反思】若用少量的稀盐酸鉴定氢氧化钠是否变质,发现无气泡冒出,则证明氢氧化钠溶液没有变质。对此实验结论,你是否赞同?若不赞同,还需说明理由。。五、计算题
-
24. 小明同学取14%的硫酸溶液70g于烧杯中,然后向烧杯中慢慢加入10g氧化铜粉末并不断搅拌,测得烧杯中溶液的质量与加入氧化铜粉末的质量关系如图所示。

求:
(1)、完全反应时共消耗氧化铜的质量为g;(2)、配制14%的硫酸溶液70g,需要98%的硫酸溶液g;(3)、反应后所得溶液中溶质的质量分数为多少?(写出计算过程,最后结果保留到小数点后1位)
-
-