人教版高中化学选修四化学反应原理综合
试卷更新日期:2018-02-08 类型:同步测试
一、 单选题
-
1. 在25 ℃时,水的离子积Kw=1.0×10-14 , 在35 ℃时,水的离子积Kw=2.1×10-14 , 则下列叙述正确的是( )A、c(H+)随着温度的升高而降低 B、35 ℃时,c(H+)<c(OH-) C、35 ℃时的水比25 ℃时的水电离程度小 D、水的电离是吸热的2. 某种溶质的溶液的pH=2,向该溶液中加水到体积变为原来溶液体积的10倍,所得溶液的pH在2~3之间,则溶液中的溶质可能是( )A、强酸 B、弱酸 C、强碱 D、弱碱3. 下图是甲醇燃料电池的结构示意图,甲醇在催化剂作用下提供质子(H+)和电子,电子经外电路、质子经内电路到达另一极与氧气反应,电池总反应为2CH3OH+3O2=2CO2+4H2O。下列说法不正确的是( )
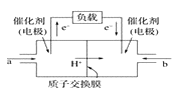 A、左电极为电池的负极,a处通入的物质是甲醇 B、正极反应式为O2+2H2O+4e-=4OH- C、负极反应式为CH3OH+H2O-6e-=CO2+6H+ D、该电池提供1 mol e- , 消耗氧气0.25 mol4. 某温度下,Fe(OH)3(s)、Cu(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液pH,金属阳离子浓度的变化如图所示。据图分析,下列判断错误的是( )
A、左电极为电池的负极,a处通入的物质是甲醇 B、正极反应式为O2+2H2O+4e-=4OH- C、负极反应式为CH3OH+H2O-6e-=CO2+6H+ D、该电池提供1 mol e- , 消耗氧气0.25 mol4. 某温度下,Fe(OH)3(s)、Cu(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液pH,金属阳离子浓度的变化如图所示。据图分析,下列判断错误的是( )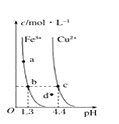 A、Ksp[Fe(OH)3]<Ksp[Cu(OH)2] B、加适量NH4Cl固体可使溶液由a点变到b点 C、c、d两点代表的溶液中c(H+)与c(OH-)乘积相等 D、Fe(OH)3、Cu(OH)2分别在b、c两点代表的溶液达到饱和5. 下图为直流电源电解稀Na2SO4水溶液的装置。通电后在石墨电极a和b附近分别滴加几滴石蕊溶液。下列实验现象描述正确的是( )
A、Ksp[Fe(OH)3]<Ksp[Cu(OH)2] B、加适量NH4Cl固体可使溶液由a点变到b点 C、c、d两点代表的溶液中c(H+)与c(OH-)乘积相等 D、Fe(OH)3、Cu(OH)2分别在b、c两点代表的溶液达到饱和5. 下图为直流电源电解稀Na2SO4水溶液的装置。通电后在石墨电极a和b附近分别滴加几滴石蕊溶液。下列实验现象描述正确的是( )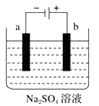 A、逸出气体的体积,a电极的小于b电极的 B、一电极逸出无味气体,另一电极逸出刺激性气体 C、a电极附近呈红色,b电极附近呈蓝色 D、a电极附近呈蓝色,b电极附近呈红色6. 下列电离方程式错误的是( )A、(NH4)2SO4溶于水:(NH4)2SO4=2
A、逸出气体的体积,a电极的小于b电极的 B、一电极逸出无味气体,另一电极逸出刺激性气体 C、a电极附近呈红色,b电极附近呈蓝色 D、a电极附近呈蓝色,b电极附近呈红色6. 下列电离方程式错误的是( )A、(NH4)2SO4溶于水:(NH4)2SO4=2 +SO42-
B、H2SO4溶于水:H2SO4 2H++SO42-
C、HF溶于水:HF H++F
D、NaHCO3溶于水:NaHCO3=Na++HCO3-、HCO3- H++CO32-
7. 在较稀FeCl3溶液中,存在如下水解平衡:Fe3++3H2O Fe(OH)3+3H+ , 在此溶液中滴入饱和的FeCl3溶液,下列说法正确的是( )A、水解平衡不移动 B、水解平衡向逆反应方向移动 C、溶液中H+浓度增大 D、Fe3+的水解程度增大8. 现有常温时pH=1的某强酸溶液10 mL,下列操作能使溶液的pH变成2的是A、加水稀释成100 mL B、加入10 mL的水进行稀释 C、加入10 mL 0.01 mol·L-1的NaOH溶液 D、加入10 mL 0.01 mol·L-1的HCl溶液9. 已知:H2(g)+ O2(g)=H2O(l) ΔH=-285.83 kJ·mol-1
+SO42-
B、H2SO4溶于水:H2SO4 2H++SO42-
C、HF溶于水:HF H++F
D、NaHCO3溶于水:NaHCO3=Na++HCO3-、HCO3- H++CO32-
7. 在较稀FeCl3溶液中,存在如下水解平衡:Fe3++3H2O Fe(OH)3+3H+ , 在此溶液中滴入饱和的FeCl3溶液,下列说法正确的是( )A、水解平衡不移动 B、水解平衡向逆反应方向移动 C、溶液中H+浓度增大 D、Fe3+的水解程度增大8. 现有常温时pH=1的某强酸溶液10 mL,下列操作能使溶液的pH变成2的是A、加水稀释成100 mL B、加入10 mL的水进行稀释 C、加入10 mL 0.01 mol·L-1的NaOH溶液 D、加入10 mL 0.01 mol·L-1的HCl溶液9. 已知:H2(g)+ O2(g)=H2O(l) ΔH=-285.83 kJ·mol-1CO(g)+ O2(g)=CO2(g) ΔH=-282.9 kJ·mol-1
若氢气与一氧化碳的混合气体完全燃烧可生成5.4 g H2O(l),并放出114.04 kJ热量,则混合气体中CO的物质的量为( )
A、0.22 mol B、0.15 mol C、0.1 mol D、0.05 mol10. 已知热化学方程式:①C(金刚石,s)+O2(g)=CO2(g) ΔH1 ②C(石墨,s)+O2(g)=CO2(g) ΔH2
③C(石墨,s)=C(金刚石,s) ΔH3=1.9 kJ·mol-1下列说法正确的是( )
A、石墨转化成金刚石的反应是吸热反应 B、金刚石比石墨稳定 C、ΔH3=ΔH1-ΔH2 D、ΔH1>ΔH211. 下列离子方程式中,属于正确的水解反应的是( )A、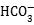 +H2O H2CO3+OH-
B、HS-+H2O S2-+H3O+
C、
+H2O H2CO3+OH-
B、HS-+H2O S2-+H3O+
C、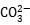 +2H2O H2CO3+2OH-
D、F-+H2O=HF+OH-
12. 关于钢铁腐蚀与防护的说法不正确的是( )A、钢铁的吸氧腐蚀和析氢腐蚀的负极反应式均为Fe-2e-=Fe2+ B、钢铁发生吸氧腐蚀时,正极反应式为O2+2H2O+4e-=4OH- C、地下钢管连接镁块是采用牺牲阳极的阴极保护法 D、用外加电流的阴极保护法防止钢铁腐蚀时,钢铁接电源的正极13. 下列关于反应热的表述正确的是( )A、当ΔH<0时,表示该反应为吸热反应 B、需要加热才能进行的反应是吸热反应 C、反应热的大小与反应物所具有的能量和生成物所具有的能量无关 D、1 mol NaOH分别和1 mol CH3COOH、1 mol HNO3反应放出的热量:CH3COOH<HNO314. 工业制硫酸中的一步重要反应是SO2的催化氧化:2SO2+O2 2SO3 ΔH<0,下列有关说法正确的是( )A、升高温度只提高逆反应速率 B、降低温度可提高正反应速率 C、升高温度平衡向正反应方向移动 D、降低温度平衡向正反应方向移动15. “生物质能”主要是指树木、庄稼、草类等植物直接或间接提供的能量;古老的柴火做饭、烧炭取暖等粗放用能方式正被现代科学技术所改变,下面说法错误的是( )A、生物质能的缺点是严重污染环境 B、生物质能源是可再生的能源 C、利用生物质能就是间接利用太阳能 D、使用沼气这种生物质能是对化学能的充分利用16. 下列关于溶液的酸碱性说法正确的是( )A、pH<7的溶液一定是酸性 B、若某盐溶液呈酸性或碱性,一定是由于该盐发生了水解反应 C、c(H+)<c(OH-)的溶液一定呈碱性 D、钠盐溶液不可能是酸性溶液
+2H2O H2CO3+2OH-
D、F-+H2O=HF+OH-
12. 关于钢铁腐蚀与防护的说法不正确的是( )A、钢铁的吸氧腐蚀和析氢腐蚀的负极反应式均为Fe-2e-=Fe2+ B、钢铁发生吸氧腐蚀时,正极反应式为O2+2H2O+4e-=4OH- C、地下钢管连接镁块是采用牺牲阳极的阴极保护法 D、用外加电流的阴极保护法防止钢铁腐蚀时,钢铁接电源的正极13. 下列关于反应热的表述正确的是( )A、当ΔH<0时,表示该反应为吸热反应 B、需要加热才能进行的反应是吸热反应 C、反应热的大小与反应物所具有的能量和生成物所具有的能量无关 D、1 mol NaOH分别和1 mol CH3COOH、1 mol HNO3反应放出的热量:CH3COOH<HNO314. 工业制硫酸中的一步重要反应是SO2的催化氧化:2SO2+O2 2SO3 ΔH<0,下列有关说法正确的是( )A、升高温度只提高逆反应速率 B、降低温度可提高正反应速率 C、升高温度平衡向正反应方向移动 D、降低温度平衡向正反应方向移动15. “生物质能”主要是指树木、庄稼、草类等植物直接或间接提供的能量;古老的柴火做饭、烧炭取暖等粗放用能方式正被现代科学技术所改变,下面说法错误的是( )A、生物质能的缺点是严重污染环境 B、生物质能源是可再生的能源 C、利用生物质能就是间接利用太阳能 D、使用沼气这种生物质能是对化学能的充分利用16. 下列关于溶液的酸碱性说法正确的是( )A、pH<7的溶液一定是酸性 B、若某盐溶液呈酸性或碱性,一定是由于该盐发生了水解反应 C、c(H+)<c(OH-)的溶液一定呈碱性 D、钠盐溶液不可能是酸性溶液二、填空题
-
17. 铅蓄电池是化学电源,其电极材料分别是铅和二氧化铅,电解质为稀硫酸,工作(放电)时该电池的总反应:Pb+PbO2+2H2SO4=2PbSO4+2H2O。试根据上述情况判断:(1)、蓄电池的负极材料是。(2)、工作时,正极反应为。(3)、工作时,电解质溶液的pH(填“增大”、“减小”或“不变”)。(4)、工作时,电解质溶液中阴离子移向极。(5)、电流方向从极流向极。18. CH4的燃烧热为893 kJ·mol-1 , 写出表示甲烷燃烧热的热化学方程式:。19. 难溶电解质在水溶液中存在着电离平衡。在常温下,溶液里各离子浓度以它们化学计量数为方次的乘积是一个常数,叫溶度积常数(Ksp)。例如:Cu(OH)2 Cu2++2OH- , Ksp=c(Cu2+)·[c(OH-)]2=2×10-20。当溶液中各离子浓度幂的乘积大于溶度积时,则产生沉淀,反之固体溶解。(1)、某CuSO4溶液里c(Cu2+)=0.02 mol·L-1 , 如要生成Cu(OH)2沉淀,应调整溶液的pH,使之大于。(2)、要使0.2 mol·L-1CuSO4溶液中Cu2+沉淀较为完全(使Cu2+浓度降至原来的千分之一),则应向溶液里加入NaOH溶液,使溶液pH为。