化学选修4第三章 水溶液中的离子平衡
试卷更新日期:2018-02-08 类型:同步测试
一、单选题
-
1. 下表中物质的分类组合完全正确的是( )
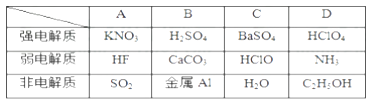 A、A B、B C、C D、D2. 下列溶液中,因为电离产生的离子发生水解而显酸性的是( )A、NaHCO3 B、NaHSO3 C、CuSO4 D、Ca(NO3)23. 在水溶液中下列电离方程式书写正确的是( )A、Ca(OH)2 Ca2++2OH- B、NaHCO3=Na++H++CO32- C、H2CO3 2H++CO32- D、Na2SO4=2Na++SO42-4. 醋酸溶液中存在电离平衡:CH3COOH H++CH3COO- , 下列叙述不正确的是( )A、升高温度,平衡正向移动,醋酸的电离常数Ka增大 B、0.10 mol·L-1的CH3COOH溶液加水稀释,溶液中c(OH-)增大 C、CH3COOH溶液中加少量的CH3COONa固体,平衡逆向移动 D、25 ℃时,欲使醋酸溶液的pH、电离常数Ka和电离程度都减小,可加入少量冰醋酸5. 已知氢氟酸在水溶液中建立如下电离平衡:HF H++ F- , 若只改变一个条件,一定可以使c(HF)/c(H+)减小的是( )A、通氯化氢气体 B、加入少量氟化钾固体 C、加入少量氢氧化钠固体 D、通入少量氟化氢气体6. 已知室温时,0.1 mol·L-1某一元酸HA的电离平衡常数约为1×10-7 , 下列叙述错误的是( )A、该溶液的pH=4 B、此溶液中,HA约有0.1%发生电离 C、加水稀释,HA的电离平衡向右移动,HA的电离平衡常数增大 D、由HA电离出的c(H+)约为水电离出的c(H+)的106倍7. 已知下面三个数据:7.2×10-4、4.6×10-4、4.9×10-10分别是三种酸的电离平衡常数,若已知这些酸可发生如下反应:①NaCN+HNO2=HCN+NaNO2 , ②NaCN+HF=HCN+NaF,③NaNO2+HF=HNO2+NaF。由此可判断下列叙述中,不正确的是( )A、HF的电离平衡常数为7.2×10-4 B、HNO2的电离平衡常数为4.9×10-10 C、根据①③两个反应即可知三种酸的相对强弱 D、HNO2的电离平衡常数比HCN大,比HF小8. 下列关于盐酸与醋酸两种稀溶液的说法正确的是( )A、相同浓度的两溶液中c(H+)相同 B、100 mL 0.1 mol·L-1的两溶液能中和等物质的量的氢氧化钠 C、c(H+)=10-3mol·L-1的两溶液稀释100倍,c(H+)都为10-5mol·L-1 D、两溶液中分别加入少量对应的钠盐,c(H+)均明显减小9. 准确移取20.00 mL某待测HCl溶液于锥形瓶中,用0.100 0 mol·L-1NaOH溶液滴定。下列说法正确的是( )
A、A B、B C、C D、D2. 下列溶液中,因为电离产生的离子发生水解而显酸性的是( )A、NaHCO3 B、NaHSO3 C、CuSO4 D、Ca(NO3)23. 在水溶液中下列电离方程式书写正确的是( )A、Ca(OH)2 Ca2++2OH- B、NaHCO3=Na++H++CO32- C、H2CO3 2H++CO32- D、Na2SO4=2Na++SO42-4. 醋酸溶液中存在电离平衡:CH3COOH H++CH3COO- , 下列叙述不正确的是( )A、升高温度,平衡正向移动,醋酸的电离常数Ka增大 B、0.10 mol·L-1的CH3COOH溶液加水稀释,溶液中c(OH-)增大 C、CH3COOH溶液中加少量的CH3COONa固体,平衡逆向移动 D、25 ℃时,欲使醋酸溶液的pH、电离常数Ka和电离程度都减小,可加入少量冰醋酸5. 已知氢氟酸在水溶液中建立如下电离平衡:HF H++ F- , 若只改变一个条件,一定可以使c(HF)/c(H+)减小的是( )A、通氯化氢气体 B、加入少量氟化钾固体 C、加入少量氢氧化钠固体 D、通入少量氟化氢气体6. 已知室温时,0.1 mol·L-1某一元酸HA的电离平衡常数约为1×10-7 , 下列叙述错误的是( )A、该溶液的pH=4 B、此溶液中,HA约有0.1%发生电离 C、加水稀释,HA的电离平衡向右移动,HA的电离平衡常数增大 D、由HA电离出的c(H+)约为水电离出的c(H+)的106倍7. 已知下面三个数据:7.2×10-4、4.6×10-4、4.9×10-10分别是三种酸的电离平衡常数,若已知这些酸可发生如下反应:①NaCN+HNO2=HCN+NaNO2 , ②NaCN+HF=HCN+NaF,③NaNO2+HF=HNO2+NaF。由此可判断下列叙述中,不正确的是( )A、HF的电离平衡常数为7.2×10-4 B、HNO2的电离平衡常数为4.9×10-10 C、根据①③两个反应即可知三种酸的相对强弱 D、HNO2的电离平衡常数比HCN大,比HF小8. 下列关于盐酸与醋酸两种稀溶液的说法正确的是( )A、相同浓度的两溶液中c(H+)相同 B、100 mL 0.1 mol·L-1的两溶液能中和等物质的量的氢氧化钠 C、c(H+)=10-3mol·L-1的两溶液稀释100倍,c(H+)都为10-5mol·L-1 D、两溶液中分别加入少量对应的钠盐,c(H+)均明显减小9. 准确移取20.00 mL某待测HCl溶液于锥形瓶中,用0.100 0 mol·L-1NaOH溶液滴定。下列说法正确的是( )
A、滴定管用蒸馏水洗涤后,装入NaOH溶液进行滴定 B、随着NaOH溶液滴入,锥形瓶中溶液pH由小变大 C、用酚酞作指示剂,当锥形瓶中溶液由红色变无色时停止滴定 D、滴定达终点时,发现滴定管尖嘴部分有悬滴,则测定结果偏小10. 今有室温下四种溶液,下列有关叙述不正确的是( ) A、③和④中分别加入适量的醋酸钠晶体后,两溶液的pH均增大 B、②和③两溶液等体积混合,所得溶液中c(H+)>c(OH-) C、分别加水稀释10倍,四种溶液的pH:①>②>④>③ D、V1L ④与V2L ①溶液混合后,若混合后溶液pH=7,则V1<V211. pH=2的A、B两种酸溶液各1 mL,分别加水稀释到1 000 mL,其中pH与溶液体积V的关系如图所示。下列说法正确的是( )
A、③和④中分别加入适量的醋酸钠晶体后,两溶液的pH均增大 B、②和③两溶液等体积混合,所得溶液中c(H+)>c(OH-) C、分别加水稀释10倍,四种溶液的pH:①>②>④>③ D、V1L ④与V2L ①溶液混合后,若混合后溶液pH=7,则V1<V211. pH=2的A、B两种酸溶液各1 mL,分别加水稀释到1 000 mL,其中pH与溶液体积V的关系如图所示。下列说法正确的是( )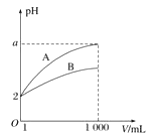 A、A,B两酸溶液的物质的量浓度一定相等 B、稀释后,A酸溶液的酸性比B酸溶液的酸性强 C、a=5时,A是强酸,B是弱酸 D、一定有关系:5>a>212. 常温下,①pH=2的CH3COOH溶液;②pH=2的H2SO4溶液;③pH=12的氨水;④pH=12的NaOH溶液。相同条件下,有关上述溶液的比较中正确的是( )A、水电离的c(H+):①=②=③=④ B、将②、④溶液混合后,pH=7,消耗溶液的体积:②<④ C、等体积的①、②、④溶液分别与足量铝粉反应,生成H2的量:②最大 D、向10 mL上述四溶液中各加入90 mL水后,溶液的pH:③>④>①>②13. 将0.1 mol·L-1HCl溶液和0.06 mol·L-1的Ba(OH)2溶液等体积混合后,则该溶液的pH是( )A、1.7 B、12.3 C、12 D、114. 常温下,0.1 mol·L-1的下列溶液中c(NH4+)最大的是( )A、NH4Al(SO4)2 B、NH4Cl C、NH3·H2O D、CH3COONH415. 关于小苏打水溶液的表述正确的是( )A、存在的电离平衡为HCO3-+H2O H2CO3+OH- B、c(Na+)+c(H+)=c(HCO3-)+c(CO32-)+c(OH-) C、HCO3-的电离程度大于HCO3-的水解程度 D、c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3)16. 根据水解反应离子方程式的书写原则及其注意的问题,判断下列选项正确的是( )A、FeCl3+3H2O=Fe(OH)3↓+3HCl B、Al2S3+6H2O 2Al(OH)3+3H2S C、S2-+2H2O H2S+2OH- D、HCO3-+H2O H2CO3+OH-17. 在25 ℃时,NH4+浓度相等的NH4Cl、CH3COONH4、NH4HSO4的溶液中,其对应溶液中溶质的物质的量浓度分别为a、b、c(单位为mol·L-1),下列判断正确的是( )A、a=b=c B、a=c>b C、b>a>c D、c>a>b18. 25℃时,三种难溶银盐的Ksp与颜色如下表,下列说法正确的是( )
A、A,B两酸溶液的物质的量浓度一定相等 B、稀释后,A酸溶液的酸性比B酸溶液的酸性强 C、a=5时,A是强酸,B是弱酸 D、一定有关系:5>a>212. 常温下,①pH=2的CH3COOH溶液;②pH=2的H2SO4溶液;③pH=12的氨水;④pH=12的NaOH溶液。相同条件下,有关上述溶液的比较中正确的是( )A、水电离的c(H+):①=②=③=④ B、将②、④溶液混合后,pH=7,消耗溶液的体积:②<④ C、等体积的①、②、④溶液分别与足量铝粉反应,生成H2的量:②最大 D、向10 mL上述四溶液中各加入90 mL水后,溶液的pH:③>④>①>②13. 将0.1 mol·L-1HCl溶液和0.06 mol·L-1的Ba(OH)2溶液等体积混合后,则该溶液的pH是( )A、1.7 B、12.3 C、12 D、114. 常温下,0.1 mol·L-1的下列溶液中c(NH4+)最大的是( )A、NH4Al(SO4)2 B、NH4Cl C、NH3·H2O D、CH3COONH415. 关于小苏打水溶液的表述正确的是( )A、存在的电离平衡为HCO3-+H2O H2CO3+OH- B、c(Na+)+c(H+)=c(HCO3-)+c(CO32-)+c(OH-) C、HCO3-的电离程度大于HCO3-的水解程度 D、c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3)16. 根据水解反应离子方程式的书写原则及其注意的问题,判断下列选项正确的是( )A、FeCl3+3H2O=Fe(OH)3↓+3HCl B、Al2S3+6H2O 2Al(OH)3+3H2S C、S2-+2H2O H2S+2OH- D、HCO3-+H2O H2CO3+OH-17. 在25 ℃时,NH4+浓度相等的NH4Cl、CH3COONH4、NH4HSO4的溶液中,其对应溶液中溶质的物质的量浓度分别为a、b、c(单位为mol·L-1),下列判断正确的是( )A、a=b=c B、a=c>b C、b>a>c D、c>a>b18. 25℃时,三种难溶银盐的Ksp与颜色如下表,下列说法正确的是( ) A、AgCl、Ag2CrO4、AgI饱和溶液中c(Ag+)依次减小 B、Ag2CrO4饱和溶液中c(Ag+)约为1.0×10-6mol·L-1 C、向AgCl悬浊液中加入足量KI溶液,沉淀将由白色转化为黄色 D、向等浓度的KCl与K2CrO4的混合溶液中滴加少量AgNO3溶液,将生成砖红色沉淀19. 溶液中含有Cl-、Br-和I-三种离子,其浓度均为0.010 mol·L-1。向该溶液中逐滴加入AgNO3溶液时,最先和最后沉淀的是[已知:Ksp(AgCl)=1.8×10-10
A、AgCl、Ag2CrO4、AgI饱和溶液中c(Ag+)依次减小 B、Ag2CrO4饱和溶液中c(Ag+)约为1.0×10-6mol·L-1 C、向AgCl悬浊液中加入足量KI溶液,沉淀将由白色转化为黄色 D、向等浓度的KCl与K2CrO4的混合溶液中滴加少量AgNO3溶液,将生成砖红色沉淀19. 溶液中含有Cl-、Br-和I-三种离子,其浓度均为0.010 mol·L-1。向该溶液中逐滴加入AgNO3溶液时,最先和最后沉淀的是[已知:Ksp(AgCl)=1.8×10-10Ksp(AgBr)=5.0×10-13Ksp(AgI)=8.3×10-17]( )
A、AgBr和AgI B、AgI和AgCl C、AgBr和AgCl D、一起沉淀20. 25 ℃时,在含有大量PbI2的饱和溶液中存在着平衡:PbI2(s) Pb2+(aq)+2I-(aq),加入KI溶液,下列说法正确的是( )A、 溶液中Pb2+和I-浓度都增大 B、溶度积常数Ksp增大 C、沉淀溶解平衡向右移动 D、溶液中Pb2+浓度减小二、填空题
-
21. 已知:
 (1)、在相同浓度的H2SO3和H2CO3的溶液中,用“>”“<”或“=”填空。
(1)、在相同浓度的H2SO3和H2CO3的溶液中,用“>”“<”或“=”填空。c(H+):H2SO3H2CO3;c(SO32-)c(CO32-);
c(H2SO3)c(H2CO3);溶液导电能力:H2SO3H2CO3。
(2)、HSO3-的电离平衡常数表达式为。(3)、H2SO3溶液与NaHCO3溶液反应的主要离子方程式为。22.(1)、明矾可用于净水,原因是(用离子方程式表示):。把FeCl3溶液蒸干,灼烧,最后得到的主要固体产物是。
(2)、用离子方程式表示泡沫灭火器灭火原理:。(3)、纯碱可代替洗涤剂洗涤餐具,原因是(用离子方程式表示):。(4)、为了除去MgCl2酸性溶液中的Fe3+ , 可在加热搅拌的条件下加入MgCO3固体,过滤后再加入足量盐酸。MgCO3固体能除去Fe3+的原因是。23. 回答下列问题:(1)、25 ℃时,pH=3的盐酸中由水电离出的c(H+)是pH=5的盐酸中由水电离的c(H+)的倍。(2)、25 ℃时,某溶液由水电离出的c(H+)=1×10-12mol·L-1 , 则该溶液的pH可能为。(3)、99 ℃时,向pH=6的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的pH=2。此时水的离子积Kw= , 水电离出的c(H+)= , 溶液中c(Na+)(填“>”“=”或“<”)c(SO42-)。(4)、25 ℃时,将amol·L-1的氨水与0.01 mol·L-1盐酸等体积混合,反应后溶液中c(NH4+)=c(Cl-),则溶液显(填“酸”“碱”或“中”)性。(5)、25 ℃时,pH=3的醋酸和pH=11的NaOH溶液等体积混合后,溶液呈(填“酸”“中”或“碱”)性,溶液中c(Na+)(填“>”“=”或“<”)c(CH3COO-)。24. 把NH4Cl晶体溶入水中,得到饱和NH4Cl溶液。若在该溶液中加入镁条,观察到有气泡产生,点燃有爆鸣声,此气体是 , 产生该气体的原因是(用离子方程式表示);微热后,能放出有刺激性气味的气体,它能使湿润的红色石蕊试纸变蓝,该气体是 , 产生该气体的原因是 ,
总的离子反应方程式为。