辽宁省葫芦岛中学2015-2016学年高二下学期化学开学考试试卷
试卷更新日期:2018-02-08 类型:开学考试
一、单选题
-
1. 分类法是快速获取物质性质的重要方法,有关分类说法不正确的是( )A、根据氧化物的性质可将氧化物分成酸性氧化物、碱性氧化物、两性氧化物和特殊氧化物等 B、根据反应中是否有电子转移将化学反应分为氧化还原反应和非氧化还原反应 C、根据分散质粒子直径大小可将液体分散系分为溶液、胶体和浊液 D、根据电解质的水溶液导电能力的强弱将电解质分为强电解质和弱电解质2. 下列有关实验叙述正确的是( )A、氢氧化铁胶体制备:向沸水中逐滴加入少量饱和硫酸铁溶液,继续加热煮沸至液体变为红褐色,停止加热 B、用容量瓶配制溶液时,定容时俯视刻度线,所配溶液浓度偏大 C、中和热实验,在操作时应将碱液分多次倒入酸中,以防液体溅出,产生误差 D、萃取碘水中的碘实验时,将碘水倒入分液漏斗,然后再注入乙醇,振荡、静置分层后,下层紫色液体先从下口放出,之后,上层无色液体从上口倒出3. 下列有关阿伏加德罗常数NA说法正确的是( )A、22 g 2H218O中含有的质子数为10NA B、标准状况下,2.24 L乙醇中含有的C-H键数目为0.5NA C、0.1 mol/L的NaF溶液中所含F﹣的数目小于0.1NA D、1 mol Na与足量O2反应,生成Na2O和Na2O2的混合物,钠失去0.5NA个电子4. 对下列现象或事实解释正确的是( )
选项 现象或事实 解释 A 已知水热反应是指在高温高压下,将二氧化碳转化为有机物的技术 水热反应可以降低自然界中碳的含量 B 用铝制易拉罐收集满CO2 , 加入过量NaOH浓溶液,立即把口封闭。发现易拉罐“咔咔”作响并变瘪了,过了一会儿,易拉罐又会作响并鼓起来 导致易拉罐又鼓起来的反应是:
Al3++3HCO3-=Al(OH)3+3CO2↑C FeCl3溶液可用于制作铜质印刷线路板的“烂板液” FeCl3溶液能将铜氧化为Cu2+ D 用浸泡过高锰酸钾溶液的硅藻土吸收水果产生的乙烯以达到保鲜目的 乙烯能够与高锰酸钾溶液发生加成反应,从而起到去除乙烯的目的 A、A B、B C、C D、D5. 下列离子方程式中正确的是( )A、氯气溶于水中:Cl2+H2O=2H++Cl-+ClO- B、硫酸氢钠溶液与氢氧化钡溶液混合至混合液呈中性:2HSO4-+Ba2++2OH-=BaSO4↓+2H2O+SO42- C、向双氧水中加入稀硫酸和KI溶液:H2O2+2H++2I﹣=I2+2H2O D、用铜作阳极电解CuSO4溶液:2Cu2++2H2O 2Cu+O2↑+ 4H+6. ①Na3N+3H2O=3NaOH+NH3↑,②NaH+H2O=NaOH+H2↑,③2Na+2H2O=2NaOH+H2↑,④ 2F2+2H2O=4HF+O2 , 有关上述反应叙述不正确的是( )
A、离子半径: N3﹣>F﹣>Na+ B、上述反应除①外都是氧化还原反应 C、反应②③中的水做氧化剂,每生成1mol H2 , 转移的电子数为2NA D、反应④中的水是还原剂7. 某化合物由五种短周期元素组成,分别为X、Y、Z、W、R,原子序数依次增大。X原子是所有原子中半径最小的,Y、R同主族,Z、W、R同周期,Y原子的最外层电子数是次外层的3倍,Z是常见的金属,电子层数等于主族序数,W单质是人类将太阳能转变为电能的常用材料。下列说法正确的是( )A、Z与Y形成的化合物是工业上制取Z的原料 B、WY2可与酸反应,但不能与碱反应 C、原子半径按X、Y、Z、R、W的顺序依次增大 D、热稳定性 :X2R>X2Y8. 下列说法错误的是( )A、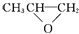 和CO2反应生成可降解聚合物
和CO2反应生成可降解聚合物  ,该反应符合绿色化学原则
B、正丁烷的二氯代物有5种(不考虑立体异构)
C、乙醇在铜催化下加热可脱氢生成乙醛,该反应属于氧化反应
D、淀粉、纤维素、麦芽糖均属于糖类,在一定条件下都可以水解得到葡萄糖
9. 下列三种烃的立体结构如图示:
,该反应符合绿色化学原则
B、正丁烷的二氯代物有5种(不考虑立体异构)
C、乙醇在铜催化下加热可脱氢生成乙醛,该反应属于氧化反应
D、淀粉、纤维素、麦芽糖均属于糖类,在一定条件下都可以水解得到葡萄糖
9. 下列三种烃的立体结构如图示: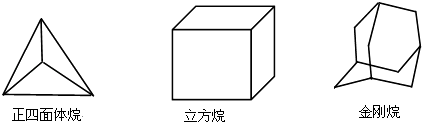
则这三种烃的二氯取代产物的同分异构体数目分别是( )
A、2,4,8 B、2,4,6 C、1,3,6 D、1,3,810. 下列说法正确的是( )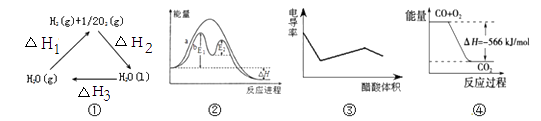 A、图①中△H2=△H1+△H3 B、图②在催化剂条件下,反应的活化能等于E1+E2 C、图③表示醋酸溶液滴定 NaOH 和氨水混合溶液的电导率变化曲线 D、图④可表示由CO(g)生成CO2(g)的过程中要放出566kJ 热量11. 中关村“创客19”实验室模拟光合作用的电化学实验装置如右图所示,该装置能将H2O和CO2转化为O2和葡萄糖(C6H12O6)。下列说法正确的是( )
A、图①中△H2=△H1+△H3 B、图②在催化剂条件下,反应的活化能等于E1+E2 C、图③表示醋酸溶液滴定 NaOH 和氨水混合溶液的电导率变化曲线 D、图④可表示由CO(g)生成CO2(g)的过程中要放出566kJ 热量11. 中关村“创客19”实验室模拟光合作用的电化学实验装置如右图所示,该装置能将H2O和CO2转化为O2和葡萄糖(C6H12O6)。下列说法正确的是( )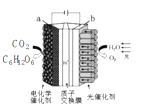 A、该装置是新型化学电源装置 B、该装置工作时,H+从a极区向b极区迁移 C、每生成1 mol O2 , 有44 g CO2被还原 D、a 电极的反应为: 6CO2 + 24H+-24e-= C6H12O6 +6 H2 O12. 某些工业废水中常是含有氰根(CN-)的无机物,有一定的毒性,有的还是剧毒。右图所示装置是工业上采用的电解法除去含CN-废水的装置。工作时控制溶液为碱性,阳极产生的ClO-将CN-氧化为两种无污染的气体,下列叙述不正确的是( )
A、该装置是新型化学电源装置 B、该装置工作时,H+从a极区向b极区迁移 C、每生成1 mol O2 , 有44 g CO2被还原 D、a 电极的反应为: 6CO2 + 24H+-24e-= C6H12O6 +6 H2 O12. 某些工业废水中常是含有氰根(CN-)的无机物,有一定的毒性,有的还是剧毒。右图所示装置是工业上采用的电解法除去含CN-废水的装置。工作时控制溶液为碱性,阳极产生的ClO-将CN-氧化为两种无污染的气体,下列叙述不正确的是( )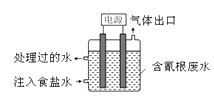 A、用石墨作阴极,铁作阳极 B、阴极的电极反应式为:2H2O + 2e- = H2↑ + 2OH- C、阳极的电极反应式为:Cl- + 2OH--2e-= ClO- + H2O D、除去CN-的反应:2CN-+5ClO-+ H2O =N2↑+2CO2↑+5Cl-+2OH-13. 在2L恒容密闭容器中充入2 mol X和1mol Y发生反应:2X(g) +Y(g)
A、用石墨作阴极,铁作阳极 B、阴极的电极反应式为:2H2O + 2e- = H2↑ + 2OH- C、阳极的电极反应式为:Cl- + 2OH--2e-= ClO- + H2O D、除去CN-的反应:2CN-+5ClO-+ H2O =N2↑+2CO2↑+5Cl-+2OH-13. 在2L恒容密闭容器中充入2 mol X和1mol Y发生反应:2X(g) +Y(g) 3Z(g) △H<0,反应过程持续升高温度,测得混合体系中X的体积分数与温度的关系如图所示。下列推断正确的是( )
3Z(g) △H<0,反应过程持续升高温度,测得混合体系中X的体积分数与温度的关系如图所示。下列推断正确的是( )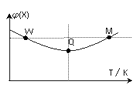 A、升高温度,平衡常数增大 B、W点X的正反应速率小于M点X的正反应速率 C、Q点时,Y的转化率最小 D、平衡时充入Z,达到新平衡时Z的体积分数比原平衡时大14. 下列说法不正确的是( )A、对于相同浓度的弱酸HX和HY(前者的Ka较小)溶液,加水稀释相同倍数时,HY溶液的pH改变值大于HX溶液的pH改变值 B、在NH3·H2O和NH4Cl浓度均为0.1 mol·L-1的体系中,外加少量酸或碱时,溶液的pH可保持基本不变 C、在NaH2PO4水溶液中存在关系:c(H3PO4) + c(H+) = c(HPO42-) + c(PO43-) + c(OH-) D、沉淀溶解平衡AgI Ag+ + I- 的平衡常数为8.5×10-17 , 不能说明难溶盐AgI是弱电解质
A、升高温度,平衡常数增大 B、W点X的正反应速率小于M点X的正反应速率 C、Q点时,Y的转化率最小 D、平衡时充入Z,达到新平衡时Z的体积分数比原平衡时大14. 下列说法不正确的是( )A、对于相同浓度的弱酸HX和HY(前者的Ka较小)溶液,加水稀释相同倍数时,HY溶液的pH改变值大于HX溶液的pH改变值 B、在NH3·H2O和NH4Cl浓度均为0.1 mol·L-1的体系中,外加少量酸或碱时,溶液的pH可保持基本不变 C、在NaH2PO4水溶液中存在关系:c(H3PO4) + c(H+) = c(HPO42-) + c(PO43-) + c(OH-) D、沉淀溶解平衡AgI Ag+ + I- 的平衡常数为8.5×10-17 , 不能说明难溶盐AgI是弱电解质二、填空题
-
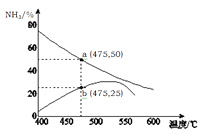
15. 大苏打(Na2S2O3·5H2O)、苏打、小苏打被称为“三苏”,它们在生活、生产中用途广泛。(1)、工业上,将苏打和硫化钠以1:2的物质的量之比配成溶液,再通入SO2气体,可制得Na2S2O3 , 同时放出CO2。写出该反应的化学方程式。硫化钠溶液在空气中久置,会生成淡黄色物质,经测定该物质具有与过氧化钠相似的结构,该物质的化学式。(2)、Na2S2O3标准液常用于滴定碘的含量,若滴定的溶液呈酸性,测定结果会偏高,用离子方程式表示其原因。(3)、工业上用大苏打溶液吸收工业废气中的氯气,其氧化产物为SO42- , 写出离子方程式。(4)、工业上常用苏打和盐酸除去锅炉中水垢中的硫酸钙。先用饱和苏打溶液浸泡锅垢,然后用盐酸清洗。“浸泡”的目的是。(并用离子方程式表示)(5)、在密闭的容器中投入一定量的Na2O2和NaHCO3固体,在300℃下充分反应。若残留固体为纯净物,则起始时n(NaHCO3):n(Na2O2)满足的条件是。16. 氨是一种重要的化工原料,也是重要的工业产品,在工农业生产和国防等领域发挥着重要作用。(1)、液氨储氢是目前研究的重要课题。液氨的电离和水的电离相似,液氨中的氨也能发生电离:NH3+NH3 NH4++NH2- , 其离子积常数为1.0×10-30。现将2.3克金属钠投入1.0 L 液氨中,待反应结束后,假设溶液体积不变,所得溶液中NH4+离子浓度为。(2)、用Pt电极对液氨进行电解可产生H2和N2 , 则阴极的电极反应式是。(3)、用NH3催化还原NXOy可以消除氮氧化合物的污染。请写出氨气催化还原NO的化学方程式。(4)、将一定量的N2和H2充入1L的密闭容器中,在500℃、2×107Pa下反应并达到平衡,测得N2为0.10 mol,H2为0.30 mol,NH3为0.10 mol,则H2的平衡转化率为;在该温度下的平衡常数K=。(5)、下图是某压强下,N2与H2按体积比1: 3投料时,反应混合物中氨的体积分数随温度的变化曲线。其中一条是经过一定时间反应后的曲线,另一条是平衡时的曲线。则图中b点,v(正)v(逆)。(填“>”、“=”或“<”)
 17. 巴伊亚祖母绿号称是世界上最大的祖母绿矿石,重380余公斤,含有约18万克拉的祖母绿宝石,价值约4亿美元。祖母绿的元素组成是O、Si、Al、Be,化学式为Be3Al2Si6O18 。(1)、基态Al原子中,电子占据的最高能级的符号是 , 该能级具有的原子轨道数为。(2)、在500~600℃气相中,氯化铍以二聚体Be2Cl4的形式存在(如图),在1000℃,氯化铍则以BeCl2形式存在。在BeCl2分子中,Be的杂化方式为 , 二聚体Be2Cl4中Be的杂化方式为 , 1mol Be2Cl4中含有mol配位键。
17. 巴伊亚祖母绿号称是世界上最大的祖母绿矿石,重380余公斤,含有约18万克拉的祖母绿宝石,价值约4亿美元。祖母绿的元素组成是O、Si、Al、Be,化学式为Be3Al2Si6O18 。(1)、基态Al原子中,电子占据的最高能级的符号是 , 该能级具有的原子轨道数为。(2)、在500~600℃气相中,氯化铍以二聚体Be2Cl4的形式存在(如图),在1000℃,氯化铍则以BeCl2形式存在。在BeCl2分子中,Be的杂化方式为 , 二聚体Be2Cl4中Be的杂化方式为 , 1mol Be2Cl4中含有mol配位键。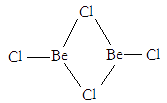 (3)、氢化铝锂(LiAlH4)是有机合成中的一种重要还原剂,可以将羧基还原为羟基,如可将乙酸还原为乙醇,乙酸和乙醇的熔沸点数据如下:
(3)、氢化铝锂(LiAlH4)是有机合成中的一种重要还原剂,可以将羧基还原为羟基,如可将乙酸还原为乙醇,乙酸和乙醇的熔沸点数据如下:乙酸
乙醇
熔点/℃
16.6
-114.3
沸点/℃
117.9
78.4
乙酸分子中σ键与π键数目之比为 , 由表格中的数据知,乙酸的熔沸点均比乙醇高,原因是。
(4)、图示为Be与O形成的氧化物的立方晶胞结构,已知氧化铍的密度ρ=3.00g/cm3 , 则晶胞参数a=nm。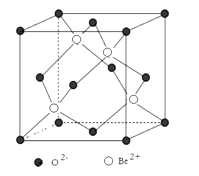
三、实验题
-
18. 磷酸亚铁[Fe3(PO4)2·8H2O]为白蓝色晶体,溶于强酸,不溶于水、醋酸和乙醇。主要用于制造磷酸铁锂电池。实验室制备磷酸亚铁的装置示意图、
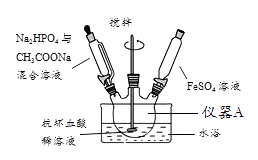
反应和实验步骤如下。主要反应为:
3FeSO4+2Na2HPO4+2CH3COONa+8H2O=Fe3(PO4)2·8H2O↓+3Na2SO4+2CH3COOH
实验步骤:①在仪器A中先加入抗坏血酸(C6H8O6)稀溶液作底液②向仪器A中,滴入Na2HPO4与CH3COONa混合溶液至pH=4 ③滴入15.2克FeSO4溶液,最终维持pH=6,充分反应后,静置④进行操作a,干燥得到的磷酸亚铁12.8克。
(1)、仪器A的名称是。(2)、实验中配制FeSO4溶液时,先要对蒸馏水进行的操作是。(3)、实验中不是将三种溶液直接混合的原因是 , 反应时需不断搅拌,其目的是。(4)、步骤④进行的操作a是。(5)、检验磷酸亚铁粗产品中是否混有氢氧化铁杂质的方法是。(6)、本实验的产率是。四、推断题
-
19. (本题绥一高中考生不做答,其他考生必做)奈必洛尔是一种用于血管扩张的降血压药物。用于合成奈必洛尔中间体G的部分流程如下:

已知:乙酸酐的结构简式为
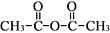
请回答下列问题:
(1)、G物质中的含氧官能团的名称是、。(2)、反应A→B的化学方程式为。(3)、上述④、⑤变化过程的反应类型分别是、。(4)、写出满足下列条件的C的一种同分异构体的结构简式:Ⅰ.苯环上只有两种取代基。
Ⅱ.分子中只有4种不同化学环境的氢。
Ⅲ.能与NaHCO3反应生成CO2。
(5)、根据已有知识并结合相关信息,写出以 和乙酸酐为原料制备
和乙酸酐为原料制备 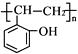 的合成路线流程图(无机试剂任选)。合成路线流程图示例如下:
的合成路线流程图(无机试剂任选)。合成路线流程图示例如下: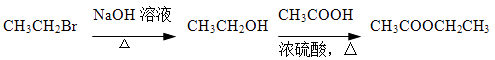
-