江苏省泰州市姜堰区2014-2015学年高三下学期化学开学考试试卷
试卷更新日期:2018-02-07 类型:开学考试
一、单选题
-
1. 化学与生产、生活、环境保护等密切相关。下列叙述正确的是( )A、绿色食品是生产时不使用化肥农药,不含任何化学物质的食品 B、新型材料聚酯纤维、光导纤维都属于有机高分子材料 C、医药中常用酒精来消毒,是因为酒精能够使病毒的蛋白质发生变性 D、CO2的水溶液呈酸性,CO2的大量排放会导致酸雨的形成2. 下列化学用语表示正确的是( )A、乙烯的结构简式:CH2CH2 B、S2-的结构示意图:
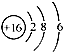 C、中子数为20的氯原子:
C、中子数为20的氯原子: 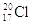 D、羟基的电子式:
D、羟基的电子式:  3. 常温下,下列各组离子在指定溶液中一定能大量共存的是( )A、使苯酚显紫色的溶液:NH4+、K+、SCN-、SO42- B、使甲基橙变红色的溶液:Mg2+、K+、SO42- 、NO3- C、由水电离的c(OH-)=10-13mol·L-1的溶液中:Na+、Cl-、CO32-、NO3- D、c(Fe2+)=1.0 mol·L-1溶液:H+、K+、Cl-、NO3-4. 下列物质性质与应用对应关系均正确的是( )A、SO2具有漂白性,可用SO2加工银耳,使之更白 B、炭具有强还原性,常用于冶炼镁、钠等金属 C、淀粉遇碘变蓝色,常用于检验食盐是否为加碘盐 D、NaHCO3可以与胃酸反应,可用NaHCO3治疗胃酸过多5.
3. 常温下,下列各组离子在指定溶液中一定能大量共存的是( )A、使苯酚显紫色的溶液:NH4+、K+、SCN-、SO42- B、使甲基橙变红色的溶液:Mg2+、K+、SO42- 、NO3- C、由水电离的c(OH-)=10-13mol·L-1的溶液中:Na+、Cl-、CO32-、NO3- D、c(Fe2+)=1.0 mol·L-1溶液:H+、K+、Cl-、NO3-4. 下列物质性质与应用对应关系均正确的是( )A、SO2具有漂白性,可用SO2加工银耳,使之更白 B、炭具有强还原性,常用于冶炼镁、钠等金属 C、淀粉遇碘变蓝色,常用于检验食盐是否为加碘盐 D、NaHCO3可以与胃酸反应,可用NaHCO3治疗胃酸过多5.下列有关实验原理或实验操作正确的( )
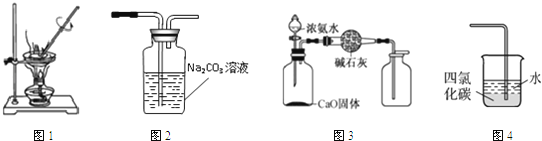 A、用图1所示装置蒸干NH4Cl饱和溶液制备NH4Cl晶体 B、用图2所示装置除去CO2中含有的少量HCl C、用图3所示装置制取并收集干燥纯净的NH3 D、用图4所示装置吸收氨气并防止倒吸6. 设NA为阿伏加德罗常数的值。下列说法正确的是( )A、常温常压下,4.4 g CO2与N2O混合气体中含有的原子总数为0.3NA B、标准状况下,2.24L己烷含有分子的数目为0.1NA C、1 L 1 mol·L-1的CuCl2 溶液中含有Cu2+的数目为NA D、在过氧化钠与水的反应中,每生成0.1mol氧气,转移电子的数目为0.4NA7. 下列指定反应的离子方程式正确的是( )A、向Na2SiO3溶液中通入过量CO2: SiO32-+CO2+H2O = H2SiO3↓+CO32- B、酸性介质中KMnO4氧化H2O2:2MnO4- +5H2O2+6H+= 2Mn2++5O2↑+8H2O C、等物质的量的MgCl2、Ba(OH)2 和 HCl 溶液混合:Mg2++2OH-= Mg(OH)2↓ D、用CH3COOH溶解CaCO3:CaCO3+2H+=Ca2++H2O+CO2↑8. 下列各组物质中,不满足组内任意两种物质在一定条件下均能发生反应的是( )
A、用图1所示装置蒸干NH4Cl饱和溶液制备NH4Cl晶体 B、用图2所示装置除去CO2中含有的少量HCl C、用图3所示装置制取并收集干燥纯净的NH3 D、用图4所示装置吸收氨气并防止倒吸6. 设NA为阿伏加德罗常数的值。下列说法正确的是( )A、常温常压下,4.4 g CO2与N2O混合气体中含有的原子总数为0.3NA B、标准状况下,2.24L己烷含有分子的数目为0.1NA C、1 L 1 mol·L-1的CuCl2 溶液中含有Cu2+的数目为NA D、在过氧化钠与水的反应中,每生成0.1mol氧气,转移电子的数目为0.4NA7. 下列指定反应的离子方程式正确的是( )A、向Na2SiO3溶液中通入过量CO2: SiO32-+CO2+H2O = H2SiO3↓+CO32- B、酸性介质中KMnO4氧化H2O2:2MnO4- +5H2O2+6H+= 2Mn2++5O2↑+8H2O C、等物质的量的MgCl2、Ba(OH)2 和 HCl 溶液混合:Mg2++2OH-= Mg(OH)2↓ D、用CH3COOH溶解CaCO3:CaCO3+2H+=Ca2++H2O+CO2↑8. 下列各组物质中,不满足组内任意两种物质在一定条件下均能发生反应的是( )物质
组别
甲
乙
丙
A
FeCl2
Cl2
NaOH
B
SiO2
NaOH
HF
C
AlCl3
KOH
H2SO4
D
SO2
NaOH
NaHCO3
A、A B、B C、C D、D9. 甲~辛等元素在周期表中的相对位置如下表。甲与戊的原子序数相差3,戊的一种单质是自然界硬度最大的物质,丁与辛属同周期元素,下列判断正确的是( )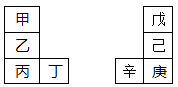 A、金属性:甲>乙>丁 B、原子半径:辛>戊>甲 C、丙与庚的元素原子核外电子数相差13 D、形成的最简单氢化物的稳定性:己>戊10. 室温下,将1mol的CuSO4•5H2O(s)溶于水会使溶液温度降低,热效应为△H1 , 将1mol的CuSO4(s)溶于水会使溶液温度升高,热效应为△H2 , CuSO4•5H2O受热分解的化学方程式为:CuSO4•5H2O(s) CuSO4(s)+5H2O(l),热效应为△H3。则下列判断正确的是( )A、△H2>△H3 B、△H1<△H3 C、△H1+△H3=△H2 D、△H1+△H2>△H311. 下列有关说法正确的是( )A、2NO(g)+2CO(g)=N2(g)+2CO2(g)在常温下能自发进行,则该反应的△H>0 B、将钢闸门与直流电源的正极相连,可防止钢闸门腐蚀 C、恒温下,体积可变的密闭容器中发生反应2NO2 N2O4 , 向平衡体系中充入氩气,达到新平衡时,NO2的百分含量增大 D、25℃时,将NH3•H2O稀溶液加水稀释, 的值不变12. 某有机物的结构简式如图所示,下列有关该物质的叙述错误的是( )
A、金属性:甲>乙>丁 B、原子半径:辛>戊>甲 C、丙与庚的元素原子核外电子数相差13 D、形成的最简单氢化物的稳定性:己>戊10. 室温下,将1mol的CuSO4•5H2O(s)溶于水会使溶液温度降低,热效应为△H1 , 将1mol的CuSO4(s)溶于水会使溶液温度升高,热效应为△H2 , CuSO4•5H2O受热分解的化学方程式为:CuSO4•5H2O(s) CuSO4(s)+5H2O(l),热效应为△H3。则下列判断正确的是( )A、△H2>△H3 B、△H1<△H3 C、△H1+△H3=△H2 D、△H1+△H2>△H311. 下列有关说法正确的是( )A、2NO(g)+2CO(g)=N2(g)+2CO2(g)在常温下能自发进行,则该反应的△H>0 B、将钢闸门与直流电源的正极相连,可防止钢闸门腐蚀 C、恒温下,体积可变的密闭容器中发生反应2NO2 N2O4 , 向平衡体系中充入氩气,达到新平衡时,NO2的百分含量增大 D、25℃时,将NH3•H2O稀溶液加水稀释, 的值不变12. 某有机物的结构简式如图所示,下列有关该物质的叙述错误的是( )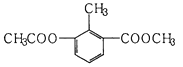 A、分子式为C11H12O4 B、苯环上的一氯代物有2种 C、分子中所有的碳原子可能共平面 D、能使酸性KMnO4溶液褪色13. 下列根据实验操作和现象所得出的结论正确的是( )
A、分子式为C11H12O4 B、苯环上的一氯代物有2种 C、分子中所有的碳原子可能共平面 D、能使酸性KMnO4溶液褪色13. 下列根据实验操作和现象所得出的结论正确的是( )选项
实验操作
实验现象
结 论
A
向某溶液中先加氯水再加KSCN溶液
溶液呈血红色
原溶液中定含Fe2+
B
向无色溶液中加盐酸酸化的BaCl2溶液
有白色沉淀
原溶液中定含SO42-
C
向Na2SiO3溶液中通入适量CO2气体
出现白色胶状沉淀
碳的非金属性大于硅
D
用铂丝蘸取某物质的溶液进行焰色反应
火焰呈黄色
该物质定是钠盐
A、A B、B C、C D、D14. 25 ℃时,下列溶液中微粒的物质的量浓度关系正确的是( )A、Na2CO3溶液:c(OH-)-c(H+)=c(HCO3-)+ 2c(H2CO3) B、浓度均为0.1 mol·L-1的CH3COOH和CH3COONa混合液(pH<7):c(CH3COOH)>c(CH3COO-)>c (Na+)>c(H+)>c(OH-) C、浓度均为0.1 mol·L-1的NaClO、NaHCO3混合溶液中:c(HClO)+c(ClO-)=c(HCO3-)+ c(H2CO3) D、向0.1 mol/L NH4HSO4溶液中滴加NaOH溶液至中性:c(Na+)>c(SO42-)>c(NH4+)>c (OH-)=c(H+)15. 一定条件下进行反应:A(g) B(g)+C (g),向2.0 L恒容密闭容器中充入1.0 mol A(g),经过一段时间后达到平衡。反应过程中测得的有关数据见下表:t/s
0
2
4
6
8
n(B)/mol
0
0.30
0.39
0.40
0.40
下列说法正确的是( )
A、反应前2min的平均速率v(B)=0.15 mol/(L·min) B、保持其他条件不变,升高温度,平衡时c(B)=0.22 mol·L-1 , 则反应的ΔH < 0 C、保持其他条件不变,起始向容器中充入2.0 mol A,反应达到平衡时C的体积分数减小 D、保持其他条件不变,起始向容器中充入1.2 molA、 0.60 mol B和0.60 mol C,反应达到平衡前的速率:v(正)<v(逆)二、综合题
-
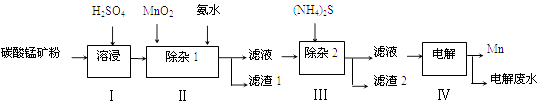
16. 锰的用途非常广泛,在钢铁工业中,锰的用量仅次于铁,90%的锰消耗于钢铁工业,10%的锰消耗于有色冶金、化工、电子、电池、农业等部门。以碳酸锰矿(主要成分为MnCO3 , 还含有铁、镍、钴等碳酸盐杂质)为原料生产金属锰的工艺流程如下:
已知25℃,部分物质的溶度积常数如下:
物质
Mn(OH)2
Co(OH)2
Ni(OH)2
MnS
CoS
NiS
Ksp
2.1×10-13
3.0×10-16
5.0×10-16
1.0×10-11
5.0×10-22
1.0×10-22
(1)、步骤Ⅰ中,MnCO3与硫酸反应的化学方程式是 。(2)、步骤Ⅰ中需要加入稍过量的硫酸,其目的有3点:①使矿物中的物质充分反应;②提供第Ⅱ步氧化时所需要的酸性环境;③。(3)、步骤Ⅱ中,MnO2在酸性条件下可将Fe2+氧化为Fe3+ , 该反应的离子方程式是 , 加氨水调节溶液的pH为5.0~6.0,以除去Fe3+。(4)、步骤Ⅲ中,滤渣2的主要成分是 。(5)、步骤Ⅳ中,在(填“阴”或“阳”)极析出Mn,电极反应方程式为。(6)、电解后的废水中还含有Mn2+ , 常用石灰乳进行一级沉降得到Mn(OH)2沉淀,过滤后再向滤液中加入适量Na2S,进行二级沉降。欲使溶液中c(Mn2+)≤1.0×10-5 mol·L-1 , 则应保持溶液中c(S2-)≥mol·L-1。三、推断题
-
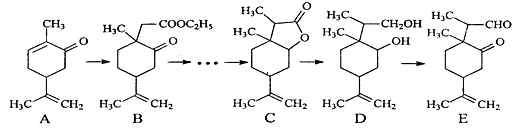
17. 下图是一种天然药物桥环分子合成的部分路线图(反应条件已经略去):
已知:
①LiBH4可将醛、酮、酯类还原成醇,但不能还原羧酸、羧酸盐、碳碳双键;LiBH4遇酸易分解。
请回答下列问题:
(1)、有机物B中含氧官能团的名称。(2)、反应A→B中需要加入试剂X,其分子式为C4H8O2 , X的结构简式为。(3)、C用LiBH4还原得到D。C→D不直接用H2(镍作催化剂)还原的原因是。(4)、写出一种满足下列条件的A的同分异构体的结构简式为。①属于芳香族化合物;②能使FeCl3溶液显色;③分子中有4种不同化学环境的氢。
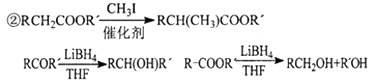
(5)、写出E和银氨溶液反应的化学方程式。(6)、根据已有知识并结合相关信息,设计B→C的合成路线图(CH3I和无机试剂任选)。合成路线流程图例如下:

四、填空题
-
18. 平板电视显示屏生产过程中产生大量的废玻璃粉末(含SiO2、Fe2O3、CeO2、FeO等物质)。某课题以此粉末为原料,设计如下工艺流程对资源进行回收,得到Ce(OH)4和硫酸铁铵:

已知:
①酸性条件下,铈在水溶液中有 、 两种主要存在形式, 易水解, 有较强氧化性。
②CeO2不溶于稀硫酸
③硫酸铁铵[aFe2(SO4) 3•b(NH4) 2SO4•cH2O]广泛用于水的净化处理。
(1)、在氧化环节,下列物质中最适合用作氧化剂B的是(填序号)。a.NaClO b.H2O2 c.KMnO4
(2)、操作Ⅰ的名称是 , 检验硫酸铁铵溶液中含有NH4+的方法是。(3)、写出反应②的化学方程式。(4)、用滴定法测定制得的Ce(OH)4产品纯度。
所用FeSO4溶液在空气中露置一段时间后再进进行滴定,则测得该Ce(OH)4产品的质量分数。(填“偏大”、“偏小”或“无影响”)
(5)、称取14.00g硫酸铁铵样品,将其溶于水配制成100mL溶液,分成两等份,向其中一份加入足量NaOH溶液,过滤洗涤沉淀并烘干灼烧至恒重得到1.60g固体;向另一份溶液中加入0.5mol/L Ba(NO3)2溶液100mL,恰好完全反应。通过计算,该硫酸铁铵的化学式为.(写出必要的计算步骤,否则不得分)。19. 常温下钛的化学活性很小,在较高温度下可与多种物质反应。工业上由金红石(含TiO2大于96%)为原料生产钛的流程如下: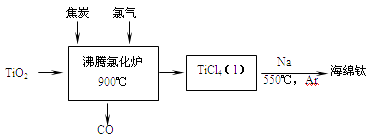 (1)、TiCl4遇水强烈水解,写出其水解的化学方程式。(2)、①若液氯泄漏后遇到苯,在钢瓶表面氯与苯的反应明显加快,原因是。
(1)、TiCl4遇水强烈水解,写出其水解的化学方程式。(2)、①若液氯泄漏后遇到苯,在钢瓶表面氯与苯的反应明显加快,原因是。②Cl2含量检测仪工作原理如下图,则Cl2在Pt电极放电的电极反应式为。

③实验室也可用KClO3和浓盐酸制取Cl2 , 方程式为:KClO3 + 6HCl(浓) = KCl + 3Cl2↑ + 3H2O。
当生成6.72LCl2(标准状况下)时,转移的电子的物质的量为 mol。
(3)、一定条件下CO可以发生如下反应:4H2(g)+2CO(g) CH3OCH3(g)+H2O(g) △H。①该反应的平衡常数表达式为K=。
②将合成气以n(H2)/n(CO)=2通入1 L的反应器中,CO的平衡转化率随温度、压强变化关系如图所示,下列判断正确的是(填序号)。

a.△H <0
b.P1<P2<P3
c.若在P3和316℃时,起始时n(H2)/n(CO)=3,则达到平衡时,CO转化率小于50%
③采用一种新型的催化剂(主要成分是Cu-Mn的合金),利用CO和H2制备二甲醚(简称DME)。观察下图回答问题。

催化剂中n(Mn)/n(Cu)约为时最有利于二甲醚的合成。
20. 前四周期元素A、B、C、D、E原子序数依次增大,A是周期表所有原子中原子半径最小的,B有三个能级,且各个能级上电子数相等,D与C同周期,且C中未成对电子是该周期中最多的;D基态原子的2p电子是2s电子的2倍;E有4个电子层,且与A最外层电子数相同,其他各层均排满。(1)、写出E2+的基态核外电子排布式。(2)、A和C可以形成18电子的分子,该分子中C原子的杂化方式为。(3)、C与D形成的酸根离子CD3-①CD3-的空间构型为(用文字描述)。
②写出一种与CD3-互为等电子体的分子的化学式。
(4)、CA3的沸点比BA4的沸点高的原因是。(5)、E2+与C的常见氢化物形成配位数为4的配合物离子,1mol该离子中含σ键数目为。(6)、E晶胞结构如图所示,该晶体中每个E原子周围距离最近的E原子数目为。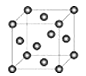
五、实验题
-
21. 利用废铝箔(主要成分为Al、少量的Fe、Si等)既可制取有机合成催化剂AlBr3又可制取净水剂硫酸铝晶体[Al2(SO4)3•18H2O]。
I.实验室制取无色的无水AlBr3(熔点:97.5℃,沸点:263.3~265℃)可用如图所示装置
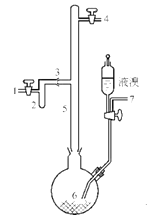
主要实验步骤如下:
步骤1:将铝箔剪碎,用CCl4浸泡片刻,干燥,然后投入到烧瓶6中。
步骤2:从导管口7导入氮气,同时打开导管口1和4放空,一段时间后关闭导管口7和1;导管口4接装有P2O5的干燥管。
步骤3:从滴液漏斗滴入一定量的液溴于烧瓶6中,并保证烧瓶6中铝过剩。
步骤4:加热烧瓶6,回流一定时间。
步骤5:将氮气的流动方向改为从导管口4到导管口l。将装有P2O5的干燥管与导管口1连接,将烧瓶6加热至270℃左右,使溴化铝蒸馏进入收集器2。
步骤6:蒸馏完毕时,在继续通入氮气的情况下,将收集器2从3处拆下,并立即封闭3处。
(1)、步骤1中,铝箔用CCl4浸泡的目的是。(2)、步骤2操作中,通氮气的目的是。(3)、步骤3中,该实验要保证烧瓶中铝箔过剩,其目的是。(4)、步骤4依据何种现象判断可以停止回流操作。(5)、步骤5需打开导管口l和4,并从4通入N2的目的是。(6)、II.某课外小组的同学拟用废铝箔制取硫酸铝晶体,已知铝的物种类别与溶液pH关系如图所示。
实验中可选用的试剂:①处理过的铝箔;②2.0 mol•L-1硫酸;③2.0mol•L-1NaOH溶液。
由铝箔制备硫酸铝晶体的实验步骤依次为:
①称取一定质量的铝箔于烧杯中,分次加入2.0 mol•L-1NaOH溶液,加热至不再产生气泡为止。
②过滤。
③。
④过滤、洗涤。
⑤。
⑥蒸发浓缩。
⑦冷却结晶。
⑧过滤、洗涤、干燥。
-
-