上海市黄浦区2017-2018学年九年级上学期化学期末考试试卷
试卷更新日期:2018-02-07 类型:期末考试
一、单选题
-
1. 元素符号与名称都正确的是( )A、H2:氢元素 B、HG:汞元素 C、He2:氦元素 D、Ag:银元素2. 表示1个氧分子的化学符号是( )A、O B、O3 C、O2 D、2O3. 硫化镉是纹身彩贴的主要成分,硫化镉中Cd的化合价为+2价,则硫化镉的化学式是( )A、Cd2S B、CdS2 C、Cd2S3 D、CdS4. 空气中体积分数约为21%的气体是( )A、氮气 B、氧气 C、二氧化碳 D、稀有气体5. 属于氧化物的是( )A、氯酸钾 B、空气 C、液氧 D、二氧化锰6. 属于有毒气体的是( )
A、N2 B、O2 C、CO D、CO27. 关于“甲烷”说法错误的是( )A、类别:有机物 B、摩尔质量:16 C、性质:可燃性 D、用途:燃料8. 氧化钙的俗称是( )
A、大理石 B、熟石灰 C、石灰水 D、生石灰9. 属于物理性质的是( )
A、导电性 B、可燃性 C、稳定性 D、还原性10. 镁在空气中燃烧时,现象描述错误的是( )
A、放出热量 B、生成MgO C、发出耀眼强光 D、金属镁消失11. 干冰可以用于人工降雨,当飞机播洒干冰后,云层中二氧化碳分子不发生的变化是( )
A、分子间的间隔 B、分子运动速率 C、物理性质 D、化学性质12. 在实验室白磷的保存方法如图所示,其目的是( ) A、降低白磷的着火点 B、防止白磷与空气接触 C、使白磷与水形成稳定物质 D、将白磷浸湿使其不易着火13. 属于同素异形体的是( )A、氢气与液态氢 B、水与冰 C、二氧化硫与三氧化硫 D、石墨与C6014. 关于“物质的量”理解正确的是( )
A、降低白磷的着火点 B、防止白磷与空气接触 C、使白磷与水形成稳定物质 D、将白磷浸湿使其不易着火13. 属于同素异形体的是( )A、氢气与液态氢 B、水与冰 C、二氧化硫与三氧化硫 D、石墨与C6014. 关于“物质的量”理解正确的是( )
A、符号可以用“mol”表示 B、摩尔是国际单位制中7个基本量之一 C、摩尔质量等于物质的式量 D、物质的量用于表示微粒的集合体15. 向15mLpH为5的溶液中加入等体积的下列试剂,混合液的pH肯定增大的是( )
A、氢氧化钠溶液 B、稀盐酸 C、稀硫酸 D、pH为5的溶液16. 下列化学方程式中,书写正确的是( )A、NaOH+ CuSO4=Cu(OH)2↓+ Na2 SO4 B、4P + 5O2↑ P2O5 C、CO2 + H2O=H2CO3 D、4Fe + 3O2 2Fe2O317. 不能鉴别氧气和二氧化碳方法是 ( )
A、通入紫色石蕊溶液 B、通入有酚酞试液的水 C、插入燃着的木条 D、通入澄清的石灰水18. 下图是恒温下模拟海水晒盐的过程示意图,根据图示判断正确的是( ) A、氯化钠溶解度受温度影响不大,且随温度升高而增大 B、乙烧杯的溶液是饱和溶液 C、丙和丁溶液中溶质质量分数相同 D、甲乙烧杯中的溶液溶质的质量分数可能相同19. 在化学反应A+B2=2C中,已知20gA和足量B2充分反应后,生成30gC。已知B的相对原子质量为16,则C的相对分子质量是( )
A、氯化钠溶解度受温度影响不大,且随温度升高而增大 B、乙烧杯的溶液是饱和溶液 C、丙和丁溶液中溶质质量分数相同 D、甲乙烧杯中的溶液溶质的质量分数可能相同19. 在化学反应A+B2=2C中,已知20gA和足量B2充分反应后,生成30gC。已知B的相对原子质量为16,则C的相对分子质量是( )
A、20 B、32 C、48 D、9620. 现有0.1mol氯酸钾和二氧化锰混合,加热一段时间后,剩余固体中氯元素的质量为3.55g,判断氯酸钾分解程度是( )
A、完全分解 B、部分分解 C、没有分解 D、无法确定二、综合题
-
21. 化学与生活密切相关。
①下图是营养药品的部分说明。说明中的“铁”指的是(填“单质”、“元素”或“分子”);丙酸钠是由种元素组成。1molC3H5OxNa中含有个碳原子;该化合物中碳元素与氧元素的质量比为9∶8则x=。
营养成分
每片含量
每100g含量
铁Fe
6.70mg
1.12g
丙酸钠C3H5OxNa
0.23mg
45.50mg
②变色眼镜的玻璃里加入了溴化银(AgBr)和氧化铜。在强光照射下,溴化银分解成溴和银,玻璃颜色变深,此属于反应(填“化合反应”或“分解反应”);当光线变暗时,溴和银在氧化铜作用下,重新生成溴化银,玻璃颜色变浅,而氧化铜在变化前后质量和化学性质没有变化,则氧化铜在反应中起作用。眼镜的铜螺丝部位常出现一层绿色物质,这是由于铜生锈的原因:请完成该反应的化学方程式:2Cu+O2++H2O=Cu2(OH)2CO3
22. 水在生产、生活中有着十分重要的作用。①科学家在不断研究水的开发和利用技术。下图是水在一定条件下的转化过程。

Ⅰ.写出电解水装置反应的化学方程式。
Ⅱ.燃料电池反应的微观模拟图如下图所示

“
 ”表示的微粒名称是;反应后的容器中成分判断正确的是。(选填编号)
”表示的微粒名称是;反应后的容器中成分判断正确的是。(选填编号)A.是混合物 B. 氧元素只存在化合态
C. 原子总数减少 D. 分子总数减少
Ⅲ.该转化过程中,可循环利用的甲物质是。该技术的优点是。(选填编号)
A. 开发使用新能源 B. 减少生产过程对环境的污染
C. 可以彻底替代化石燃料 D. 主要用于证明水的组成
②净化水有多种方法。
Ⅰ.活性炭去除异味,活性炭主要起作用。消毒水时常用二氧化氯,ClO2中氯元素的化合价是。
Ⅱ.应急净水器可以将海水淡化。如用此装置将2000 g含氯化钠3%的海水暴晒4小时,可收集到500 g可饮用水,此时剩余海水中氯化钠的质量分数为。
23. 实验室制备二氧化碳的实验装置如下图所示。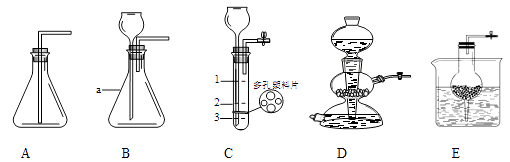
①写出仪器名称:a , D的装置的名称是。此时D装置的开关处于状态(选填“开”或“关”)。E与D装置制取气体具有相同的优点是。
②观察A~E装置,装置(选填编号)进行实验时,集气瓶中不能收集得到二氧化碳,原因是。
③用C装置制取CO2 , 反应时装置内盐酸液面应位于处(选填“1、2或3”)为宜,理由是。
④测定其大理石中碳酸钙的质量分数。在15g大理石中分5次共加入50.0g稀盐酸(假设杂质不与盐酸反应,忽略盐酸的挥发),部分数据如下表。
容器中盐酸的质量
10
20
40
50
气体质量m/g
1.1
2.2
m
4.4
根据实验数据回答下列问题:
Ⅰ. 当盐酸滴入40g时,对应的气体质量m是g。
Ⅱ. 大理石中碳酸钙的质量分数是。(根据化学方程式列式计算,结果精确到0.1%)
三、填空题
-
24. 下表是氯化钠和硝酸钾在不同温度下的溶解度。(假设硝酸钾与氯化钠同时溶解在水中各自的溶解度不变,实验过程中水分损失忽略不计)。
温度(℃)
0
20
40
60
80
100
溶解度(g/100g水)
KNO3
13.3
31.6
64.0
110.0
169.0
246.0
NaCl
35.7
36.0
36.6
37.3
38.4
39.8
①由表可知,20℃时,氯化钠的溶解度是。影响硝酸钾溶解度的因素是。
②在80℃的100g水中溶解NaCl和KNO3 , 进行以下实验:
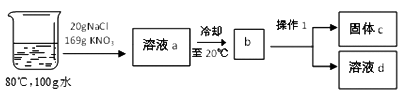
Ⅰ.操作1的名称是。
Ⅱ.溶液a冷却至b的过程中出现的现象是。溶液d中所含的溶质是。
Ⅲ.对整个实验过程分析正确的是。
A.无法判断a、d溶液中氯化钠溶液的状态 B.固体c是纯净物
C.溶液a中硝酸钾的质量分数为 D.硝酸钾溶液始终处于饱和状态
四、实验探究题
-
25. 某气体可能含有CO2 、 CO一种或二种。为探究其成分进行以下实验。
[实验步骤]
步骤一:打开K,缓缓通入干燥的氮气一段时间,关闭K。
步骤二:通入待测气体,同时打开K,点燃酒精灯,进行实验。
[实验结论] 该气体是CO、CO2混合物。

回答问题:
①写出B中玻璃管内发生反应的化学方程式。
②实验过程中,根据实验现象可以判断该气体的成分。
③对该实验的分析正确的是(选填编号)
Ⅰ.步骤一的目的是为了把容器中空气反应完
Ⅱ.C中增加的质量与B中固体减少的质量相等
Ⅲ.省略C装置对检验的结果没有影响
Ⅳ.反应结束后继续通气体的目的是防止生成的铜与空气中氧气反应
V.实验结束应先灭B处的酒精灯
-