备考2018年高考化学一轮基础复习:专题32 定量实验和化学实验的设计与评价
试卷更新日期:2018-01-30 类型:一轮复习
一、单选题
-
1. 某同学参阅了“84消毒液”说明中的配方,欲用NaClO固体配制480mL含NaClO25%,密度为1.19g/cm3的消毒液.下列说法正确的是( )A、配制过程只需要三种仪器即可完成 B、容量瓶用蒸馏水洗净后必须烘干才能用于溶液的配制 C、定容时俯视容量瓶的刻度线,会造成所配溶液物质的量浓度偏低 D、需用托盘天平称量的NaClO固体的质量为148.8g2. 用标准浓度的NaOH溶液来滴定未知浓度的盐酸,下列操作中会使盐酸测定的浓度偏大的是( )
①碱式滴定管用蒸馏水洗净后未用标准溶液润洗 ②锥形瓶中盛有少量蒸馏水,再加待测液 ③酸式滴定管用蒸馏水洗净后,未用盐酸润洗 ④滴定前碱式滴定管尖端气泡未排除,滴定后气泡消失 ⑤滴定后观察碱式滴定管读数时,俯视刻度线.
A、①④ B、①③ C、②③ D、④⑤3. 某同学为测定Na2CO3固体(含少量NaCl)的纯度,设计如图装置(含试剂)进行实验.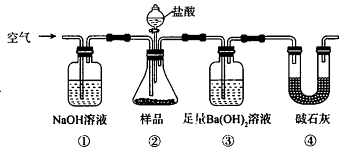
下列说法不正确的是( )
A、必须在②③间添加吸收HCl的装置 B、④的作用是防止空气中的气体影响实验的精确度 C、通入空气的作用是保证②中产生的气体完全转移到③中 D、称取样品和③中产生的沉淀的质量即可求算Na2CO3固体的纯度4. 中和热测定实验中,用50mL0.50mol/L盐酸和50mL0.55mol/LNaOH溶液进行实验,下列说法不正确的是( )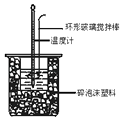 A、改用25mL 0.50mol/L盐酸跟25mL 0.55 mol/L NaOH溶液进行反应,求出的中和热数值和原来相同 B、酸碱混合时,量筒中NaOH溶液应缓缓倒入小烧杯中,不断用玻璃棒搅拌 C、装置中的大小烧杯之间填满碎泡沫塑料的作用是保温隔热减少热量损失 D、实验中应记录测量出的最高温度5. 下列实验操作能达到实验目的是( )A、用排水法收集铜粉与浓硝酸反应产生的NO2 B、用氨水鉴别NaCl、MgCl2、AlCl3、NH4Cl四种溶液 C、用酸性KMnO4溶液验证草酸的还原性 D、用饱和NaHCO3溶液除去Cl2中混有的HCl6. 海带提碘实验中,不会用到的装置是( )A、
A、改用25mL 0.50mol/L盐酸跟25mL 0.55 mol/L NaOH溶液进行反应,求出的中和热数值和原来相同 B、酸碱混合时,量筒中NaOH溶液应缓缓倒入小烧杯中,不断用玻璃棒搅拌 C、装置中的大小烧杯之间填满碎泡沫塑料的作用是保温隔热减少热量损失 D、实验中应记录测量出的最高温度5. 下列实验操作能达到实验目的是( )A、用排水法收集铜粉与浓硝酸反应产生的NO2 B、用氨水鉴别NaCl、MgCl2、AlCl3、NH4Cl四种溶液 C、用酸性KMnO4溶液验证草酸的还原性 D、用饱和NaHCO3溶液除去Cl2中混有的HCl6. 海带提碘实验中,不会用到的装置是( )A、 B、
B、 C、
C、 D、
D、 7. 下列实验“操作和现象”与“结论”对应且正确的是( )
7. 下列实验“操作和现象”与“结论”对应且正确的是( )选项
操作和现象
结论
A
将少量溴水加入KI溶液中,充分反应后再加入CCl4 , 振荡,静置,下层液体呈紫色
氧化性:Br2>I2
B
常温下,打磨后的铝片放入HNO3中,无明显现象
常温下,铝不与浓HNO3反应
C
向一定量AgNO3溶液中,先滴加KCl溶液,再滴加KI溶液,先出现白色沉淀,后出现黄色沉淀
Ksp(AgCl)>Ksp(AgI)
D
用pH计测定NaF溶液和CH3COONa溶液可知:pH(NaF)<pH(CH3COONa)
酸性:HF>CH3COOH
A、A B、B C、C D、D8. 侯氏制碱法的原理为:NH3+CO2+H2O+NaCl═NaHCO3↓+NH4Cl,2NaHCO3 Na2CO3+H2O+CO2↑,实验室模拟该过程包括制备NH3、制取NaHCO3、分离及灼烧NaHCO3四个步骤,下列图示装置能达到实验目的是( )A、 制备氨气
B、
制备氨气
B、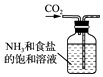 制取NaHCO3
C、
制取NaHCO3
C、 分离NaHCO3
D、
分离NaHCO3
D、 灼烧NaHCO3
灼烧NaHCO3
二、填空题
-
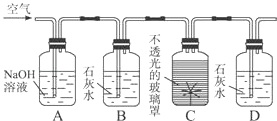
9. 图是测定植物的某一生命活动过程的实验装置.A瓶中NaOH溶液的作用是 , B瓶中的石灰水的作用是 , D瓶中出现的现象是 . 此实验说明植物具有性质.
 10. ①用50mL0.50mol/L盐酸与50mL一定浓度的NaOH溶液在如图所示的装置中进行中和反应.
10. ①用50mL0.50mol/L盐酸与50mL一定浓度的NaOH溶液在如图所示的装置中进行中和反应.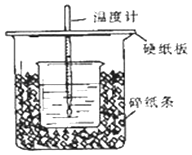
通过测定反应过程中所放出的热量可计算中和热.该装置有两处明显的错误,其中一处是缺少一种玻璃仪器,该仪器的名称 , 另一处错误是 .
②实验室提供了0.50mol/L和0.55mol/L两种浓度的NaOH溶液,应该选择mol•L﹣1的溶液进行实验.大烧杯上如不盖硬纸板,求得的中和热数值(填“偏大、偏小、无影响”).
③如果用相同浓度和体积的醋酸(CH3COOH)代替HCl溶液进行上述实验,测得的中和热的数值会;(填“偏大、偏小、无影响”) 如果用60mL0.50mol/L盐酸与50mL0.55mol/L的NaOH溶液所求中和热(填“相等、不相等”).
三、实验探究题
-
11. 某强酸性溶液X,可能含有Al3+、Ba2+、NH 、Fe2+、Fe3+、CO 、SO 、SiO 、NO 中的一种或几种离子,取该溶液进行实验,其现象及转化如图.反应过程中有一种气体是红棕色.
请回答下列问题:
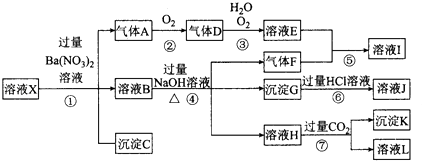 (1)、由强酸性条件即可判断溶液X中一定不存在的离子有 .(2)、溶液X中,关于NO3﹣的判断一定正确的是 .
(1)、由强酸性条件即可判断溶液X中一定不存在的离子有 .(2)、溶液X中,关于NO3﹣的判断一定正确的是 .a.一定有 b.一定没有 c.可能有
(3)、产生气体A的离子方程式为 .(4)、转化⑥发生反应的现象为 .(5)、转化④中产生H的离子方程式为 .(6)、若转化③中,D、H2O、O2三种物质恰好发生化合反应生成E,则反应中D与O2的物质的量之比为(7)、对不能确定是否存在的离子,可以另取X溶液,加入下列溶液中的一种,根据现象即可判断,该试剂最好是①NaOH溶液,②KSCN溶液,③石蕊试剂,④pH试纸,⑤KMnO4溶液,⑥氯水和KSCN的混合溶液.
四、综合题
-
12. 某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响,在常温下按照如下方案完成实验。
实验编号
反应物
催化剂
①
10 mL 2% H2O2溶液
无
②
10 mL 5% H2O2溶液
无
③
10 mL 5% H2O2溶液
1 mL 0.1 mol • L-1 FeCl3溶液
④
10 mL 5% H2O2溶液+少量HCl溶液
1 mL 0.1 mol • L-1 FeCl3溶液
⑤
10 mL 5% H2O2溶液+少量NaOH溶液
1 mL 0.1 mol • L-1 FeCl3溶液
(1)、催化剂能加快化学反应速率的原因是。(2)、实验①和②的目的是。实验时由于较长时间没有观察到明显现象而无法得出结论。资料显示,通常条件下H2O2稳定,不易分解。为了达到实验目的,你对原实验方案的改进是。(3)、写出实验③的化学反应方程式:。(4)、实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如图。分析如图能够得出的实验结论是。 13. 温州某学生用0.1000mol/L NaOH溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:
13. 温州某学生用0.1000mol/L NaOH溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步: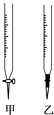
A.检查滴定管是否漏水
B.用蒸馏水洗干净滴定管
C.取下碱式滴定管用标准的NaOH溶液润洗后,将标准液注入碱式滴定管“0”刻度以上2~3cm处,再把碱式滴定管固定好,调节液面至“0”刻度或“0”刻度以下
D.用待测定的溶液润洗酸式滴定管
E.用酸式滴定管取稀盐酸20.00mL,注入锥形瓶中,加入酚酞
F.把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度
G.另取锥形瓶,再重复操作一次
完成以下填空:
(1)、操作F中应该选择图中 滴定管(填标号)。(2)、滴定时边滴边摇动锥形瓶,眼睛应观察 。A.滴定管内液面的变化 B.锥形瓶内溶液颜色的变化
滴定终点溶液颜色的变化是 .若指示剂改为甲基橙则颜色的变化是 。
(3)、滴定结果如表所示:滴定次数
待测液体积/mL
标准溶液的体积/mL
滴定前刻度
滴定后刻度
①
20
1.02
21.03
②
20
2.00
25.00
③
20
0.60
20.59
滴定中误差较大的是第 次实验,造成这种误差的可能原因是 。
A.碱式滴定管在装液前未用标准NaOH溶液润洗2~3次
B.滴定开始前碱式滴定管尖嘴部分有气泡,在滴定终点读数时未发现气泡
C.滴定开始前碱式滴定管尖嘴部分没有气泡,在滴定终点读数时发现尖嘴部分有气泡
D.达到滴定终点时,仰视溶液凹液面最低点读数
E.滴定过程中,锥形瓶摇荡得太剧烈,以致有些液滴飞溅出来
(4)、该盐酸的浓度为mol/L。
-