备考2018年高考化学一轮基础复习:专题30 物质的分离、提纯和检验
试卷更新日期:2018-01-29 类型:一轮复习
一、单选题
-
1. 下列实验操作合理的是( )
①将干燥的pH试纸浸到某溶液中,过一会取出与标准比色卡比较,测得该溶液的pH;
②用铂丝蘸取某溶液在酒精灯外焰上灼烧,直接观察火焰颜色来确认是否含有钾元素;
③通过丁达尔现象来区别硫酸铜溶液和氢氧化铁胶体;
④配制硫酸溶液时,可先在量筒中加入一定体积的水,再在搅拌下慢慢加入浓硫酸;
⑤检验红砖中的氧化铁成分时,向红砖粉末中加入盐酸,放置至充分沉淀后,取上层清液于试管中,滴加KSCN溶液即可.
A、③⑥ B、②③ C、③④⑥ D、①③④2. 下列实验方法或操作正确的是( )A、 转移溶液
B、
转移溶液
B、 制蒸馏水
C、
制蒸馏水
C、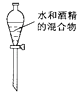 分离水和酒精
D、
分离水和酒精
D、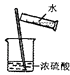 稀释浓硫酸
3. 鉴别甲烷和氢气两种无色气体的正确方法是( )A、通入溴水 B、点燃后罩上干燥的冷烧杯 C、通入澄清石灰水 D、点燃后罩上内壁涂有澄清石灰水的烧杯4. 工业废水中含有大量的FeSO4、较多的Cu2+和少量的Na+。从工业废水中回收硫酸亚铁和金属铜的工艺流程如图所示。( )
稀释浓硫酸
3. 鉴别甲烷和氢气两种无色气体的正确方法是( )A、通入溴水 B、点燃后罩上干燥的冷烧杯 C、通入澄清石灰水 D、点燃后罩上内壁涂有澄清石灰水的烧杯4. 工业废水中含有大量的FeSO4、较多的Cu2+和少量的Na+。从工业废水中回收硫酸亚铁和金属铜的工艺流程如图所示。( )
下列说法正确的是
A、试剂X为铁粉 B、操作①为过滤;操作②为分液 C、溶液1和溶液2的溶质完全相同 D、试剂Y为硫酸铜5. 萃取碘水中的碘,可用的萃取剂是( )①四氯化碳 ②汽油 ③酒精 ④苯 ⑤甲苯
A、只有①④ B、①②③④ C、①③⑤ D、①②④⑤6. 下列实验中,所采取的分离方法与对应原理都正确的是( )选项
目的
分离方法
原理
A
分离溶于水中的碘
乙醇萃取
碘在乙醇中的溶解度较大
B
分离乙酸乙酯和乙醇
分液
乙酸乙酯和乙醇的密度不同
C
除去KNO3固体中混杂的NaCl
重结晶
NaCl在水中的溶解度很大
D
除去丁醇中的乙醚
蒸馏
丁醇与乙醚的沸点相差较大
A、A B、B C、C D、D7. 图是石油分馏塔的示意图,a、b、c三种馏分中( )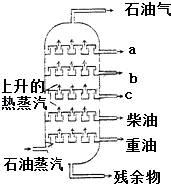 A、a的沸点最高 B、b的熔点最低 C、c的碳原子数最多 D、每一种馏分都是纯净物8. 由硫铁矿烧渣(主要成分:Fe3O4、Fe2O3和FeO)得到绿矾(主FeSO4•7H2O),再通过绿矾制备铁黄[FeO(OH)]的流程如下:烧渣 溶液 绿矾 铁黄
A、a的沸点最高 B、b的熔点最低 C、c的碳原子数最多 D、每一种馏分都是纯净物8. 由硫铁矿烧渣(主要成分:Fe3O4、Fe2O3和FeO)得到绿矾(主FeSO4•7H2O),再通过绿矾制备铁黄[FeO(OH)]的流程如下:烧渣 溶液 绿矾 铁黄已知:FeS2和铁黄均难溶于水下列说法不正确的是( )
A、步骤①,最好用硫酸来溶解烧渣 B、步骤②,涉及的离子反应为FeS2+14Fe3++8H2O═15Fe2++2SO42﹣+16H+ C、步骤③,将溶液加热到有较多固体析出,再用余热将液体蒸干,可得纯净绿矾 D、步骤④,反应条件控制不当会使铁黄中混有Fe(OH)39. 按以下实验方案可以从海洋动物柄海鞘中提取具有抗肿瘤活性的天然产物.下列说法错误的是( )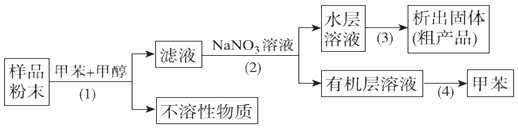 A、步骤(1)需要过滤装置 B、步骤(3)需要用到蒸发皿 C、活性天然产物易溶于有机溶剂难溶于水 D、步骤(4)是利用物质沸点差异进行分离的
A、步骤(1)需要过滤装置 B、步骤(3)需要用到蒸发皿 C、活性天然产物易溶于有机溶剂难溶于水 D、步骤(4)是利用物质沸点差异进行分离的二、填空题
-
10. 如图是实验室制乙烯并检验其性质的装置图,请回答:
 (1)、写出圆底烧瓶中反应的方程式(2)、为了检验乙烯的生成,试管中应盛放 .11. 海带中含有丰富的碘.为了从海带中提取碘,某研究性学习小组设计并进行了以下实验:
(1)、写出圆底烧瓶中反应的方程式(2)、为了检验乙烯的生成,试管中应盛放 .11. 海带中含有丰富的碘.为了从海带中提取碘,某研究性学习小组设计并进行了以下实验: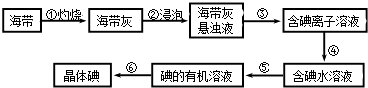 (1)、步骤③的实验操作名称是;步骤⑥的目的是从含碘苯溶液中分离出单质碘和回收苯,该步骤的实验操作名称是 .(2)、步骤④需加入的试剂是 , 反应的离子方程式是 .(3)、步骤⑤中,某学生选择用苯来提取碘,理由是 .
(1)、步骤③的实验操作名称是;步骤⑥的目的是从含碘苯溶液中分离出单质碘和回收苯,该步骤的实验操作名称是 .(2)、步骤④需加入的试剂是 , 反应的离子方程式是 .(3)、步骤⑤中,某学生选择用苯来提取碘,理由是 .三、实验探究题
-
12.
教材中有两个关于混合物分离的实验,请回答下列有关问题
实验一:通过蒸馏的方法除去自来水中含有的氯离子等杂质制取纯净水,如图所示
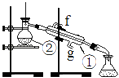 (1)、写出下列仪器的名称:①②(2)、若利用以上装置分离酒精和四氯化碳两种溶液的混合物,还缺少的仪器是 , 将仪器补充完整后进行的实验操作的名称是;②的进水口是 (填“f”或“g”)
(1)、写出下列仪器的名称:①②(2)、若利用以上装置分离酒精和四氯化碳两种溶液的混合物,还缺少的仪器是 , 将仪器补充完整后进行的实验操作的名称是;②的进水口是 (填“f”或“g”)
(3)、仪器①中常加入碎瓷片,这样做的目的是实验二:用CCl4从碘水中萃取I2并分液漏斗分离两种溶液.
其实验操作中有如下两步:①将漏斗上口玻璃塞打开或使塞上的凹槽或小孔准漏斗的小孔.②静置分层后,旋开活塞,用烧杯接收下层液体
(4)、这样做的目的是(5)、下层流出的是溶液,上层液体从得到(填“上口”或“下口”)(6)、萃取碘水中的I2单质时要用到萃取剂,下列关于所加萃取剂的说法正确的是A、不与碘反应 B、碘在其中的溶解度大于在水中的溶解度 C、该萃取剂与水不互溶且密度不同 D、可以选用CCl4 , 酒精灯做萃取剂.四、综合题
-
13. 铝是应用广泛的金属.以铝土矿(主要成分为Al2O3 , 含SiO2和Fe2O3等杂质)为原料制备铝的一种工艺流程如下:
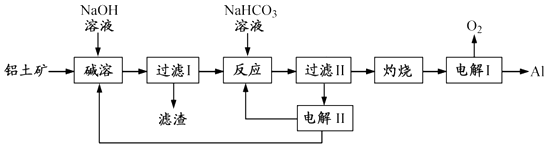
注:SiO2在“碱溶”时转化为铝硅酸钠沉淀.
(1)、“碱溶”时生成偏铝酸钠的离子方程式为 .(2)、向“过滤Ⅰ”所得滤液中加入NaHCO3溶液,溶液的pH (填“增大”、“不变”或“减小”).(3)、“电解Ⅰ”是电解熔融 Al2O3 , 电解过程中作阳极的石墨易消耗,原因是 .(4)、“电解Ⅱ”是电解Na2CO3溶液,原理如图所示.
阳极的电极反应式为 , 阴极产生的物质A的化学式为 .
(5)、铝粉在1000℃时可与N2反应制备AlN.在铝粉中添加少量NH4Cl固体并充分混合,有利于AlN的制备,其主要原因是 .14. 如图1,溶液A中可能含有Mg2+、Cu2+、Al3+、Fe2+四种阳离子,B为淡黄色固体,旋开E后,有气体放出和白色沉淀生成,淡黄色固体的物质的量与产生沉淀的质量关系如图2. (1)、则溶液中含有的阳离子有 .(2)、写出图2曲线a~b段反应的离子方程式 , .(3)、A溶液中存在的阳离子的物质的量浓度之比为 .
(1)、则溶液中含有的阳离子有 .(2)、写出图2曲线a~b段反应的离子方程式 , .(3)、A溶液中存在的阳离子的物质的量浓度之比为 .
-