辽宁省辽阳2017-2018学年高一化学期末考试题
试卷更新日期:2018-01-25 类型:期末考试
一、单选题
-
1. 下列各组物质相互反应后,没有碱生成的是 ( )A、Na2O2溶于水 B、红热的铁和水蒸气 C、金属钠投入水中 D、Na2O投入水中2. 离子方程式BaCO3+2H+=CO2↑+H2O+Ba2+中的H+不能代表的物质是( )
①HCl ②H2SO4 ③HNO3 ④NaHSO4 ⑤CH3COOH
A、①③ B、①④⑤ C、②④⑤ D、①⑤3. 下列反应的离子方程式书写正确的是( )A、钠和冷水反应Na+2H2O=Na++2OH-+H2↑ B、金属铝溶于氢氧化钠溶液:Al+2OH-=AlO2-+H2↑ C、金属铝溶于盐酸中:2Al+6H+=2Al3++3H2↑ D、铁跟稀硫酸反应:Fe+2H+=Fe3++H2↑4. 日常生活中的许多现象与化学反应有关,下列现象与氧化还原反应无关的是( )A、铜铸塑像上出现铜绿[Cu2(OH )2CO3] B、铁制菜刀生锈 C、大理石雕像被酸雨腐蚀毁坏 D、铝锅表面生成致密的氧化膜5. 关于钠的叙述中,正确的是( )A、钠是银白色金属,硬度很大 B、将金属钠放在坩埚里用酒精灯加热,金属钠剧烈燃烧,产生黄色火焰,生成淡黄色固体过氧化钠 C、金属钠在空气中燃烧,生成氧化钠 D、金属钠的熔点很高6. 地壳中含量最多的金属元素和非金属元素组成的化合物的化学式是( )A、CuO B、Al2O3 C、Fe2O3 D、SiO27. 关于Na2CO3和NaHCO3性质的说法正确的是( )A、在水中的溶解性:NaHCO3>Na2CO3 B、热稳定性:NaHCO3<Na2CO3 C、与酸反应的速率:NaHCO3<Na2CO3 D、只可能让NaHCO3转化成Na2CO38. 有两个无标签的试剂瓶,分别盛有Na2CO3、NaHCO3固体,有四位同学为鉴别它们采用了以下不同方法,其中可行的是( )A、分别将它们配制成溶液,再加入澄清石灰水 B、分别将它们配制成溶液,再加入NaOH溶液 C、分别将它们配制成溶液,再进行焰色反应 D、分别加热,再用澄清石灰水检验是否有气体产生9. 用铝箔包裹0.1mol金属钠,用针在铝箔上扎一些小孔,用镊子夹住,放入水中,待完全反应后,收集到的气体在标准状况下的体积为( )A、等于1.12L B、等于0.56L C、大于1.12L D、小于1.12L10. 铝、氧化铝、氢氧化铝和可溶性铝盐与过量强碱溶液的反应,其生成物有一定的规律,下列说法中正确的是( )A、都有H2O生成 B、都有H2生成 C、都有AlO2-生成 D、都有Al3+生成11. 向物质的量浓度均为1 mol·L-1的AlCl3和盐酸的混合溶液中逐滴滴入NaOH溶液,下图[n表示Al(OH)3的物质的量、V表示NaOH溶液的体积]能正确表示这个反应过程的是( )A、 B、
B、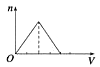 C、
C、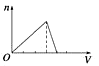 D、
D、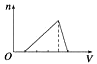 12. 能与Fe3+反应,且能证明Fe3+具有氧化性的是①SCN-②Fe ③Fe2+④Cu ⑤Zn ⑥OH-( )A、①②③ B、②④⑤ C、①③⑥ D、①②⑤13. 在反应H2S+H2SO4(浓)=S↓+SO2↑+2H2O中,若有32g硫生成则转移电子的物质的量为( )A、6mol B、2mol C、3mol D、4mol14. 现有下列几个离子反应:( )
12. 能与Fe3+反应,且能证明Fe3+具有氧化性的是①SCN-②Fe ③Fe2+④Cu ⑤Zn ⑥OH-( )A、①②③ B、②④⑤ C、①③⑥ D、①②⑤13. 在反应H2S+H2SO4(浓)=S↓+SO2↑+2H2O中,若有32g硫生成则转移电子的物质的量为( )A、6mol B、2mol C、3mol D、4mol14. 现有下列几个离子反应:( )① Cr2O
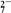 +14H++6Cl-=2Cr3++3Cl2↑+7H2O
+14H++6Cl-=2Cr3++3Cl2↑+7H2O② 2Fe2++Br2=2Fe3++2Br-③ 2Br-+Cl2= Br2+2Cl-
④2Fe3++SO2+2H2O=2Fe2++SO
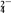 +4H+
+4H+下列有关性质的比较中正确的是( )。
A、氧化性:Cr2O72->Cl2>Fe3+ B、氧化性:Cl2>Br2>Cr2O72- C、还原性:SO2<Fe2+<Br- D、还原性:Cl->Cr3+>Fe2+15. 在强酸性无色透明溶液中,下列各组离子能大量共存的是( )A、Fe3+、K+、Cl-、MnO4- B、Ag+、Na+、NO3-、Cl- C、Zn2+、Al3+、SO42-、Cl- D、Ba2+、NH4+、Cl-、HCO3-16. 下列说法正确的是( )A、绿色食品是不含任何化学物质的食品 B、灼烧某物质时,用眼直接观察到火焰呈黄色,则可判断该物质不含钾元素 C、向新制的FeSO4溶液中滴入适量的NaOH溶液,放置片刻,整个反应过程的颜色变化是:浅绿色溶液→白色沉淀→灰绿色沉淀→红褐色沉淀 D、称取等质量的两份铝粉,分别加入过量的稀盐酸和过量的NaOH溶液,则放出氢气的体积(同温同压下)不相等二、填空题
-
17. 写出反应的化学反应方程式或离子方程式。(1)、向FeCl3溶液中滴加NaOH溶液,化学反应方程式:。(2)、向NaHCO3溶液中滴加稀HNO3 , 化学反应方程式:。(3)、向NaHCO3溶液中滴加少许Ca(OH)2溶液,离子方程式:。(4)、向AlCl3溶液中滴加NaOH溶液直至过量,总的离子方程式:。18. 电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔来制造印刷电路板。
①把FeO、Fe2O3先溶于足量的稀盐酸中、再通入适量的氯气则可制取FeCl3溶液。FeO、Fe2O3溶于足量的稀盐酸中,在上述溶液中通入适量的氯气时发生的反应的离子方程式为。若要检验溶液中Fe3+存在应选用的试剂是。
②写出FeCl3溶液与金属铜发生反应的化学方程式 , 当转移电子数为6.02×1024时,被氧化的物质的质量为
三、实验题